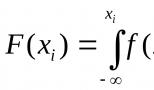Titreringsmetod i kemi. Titrimetrisk analys. Specifikt för titrimetrisk forskning
Titrimetrisk analys är en metod för att bestämma mängden av ett ämne genom att noggrant mäta volymen av lösningar av ämnen som reagerar med varandra.
Titer– mängden g av ämnet i 1 ml. lösning eller motsvarande ämne som bestäms. Till exempel, om titern för H 2 SO 4 är 0,0049 g/ml, betyder detta att varje ml lösning innehåller 0,0049 g svavelsyra.
En lösning vars titer är känd kallas titrerad. Titrering- Processen att tillsätta en ekvivalent mängd av en titrerad lösning till testlösningen eller en alikvot av den. I det här fallet används standardlösningar - fasta kanaler– lösningar med den exakta koncentrationen av ämnet (Na 2 CO 3, HCl).
Titreringsreaktionen måste uppfylla följande krav:
hög reaktionshastighet;
reaktionen måste fortsätta till fullbordan;
reaktionen måste vara mycket stökiometrisk;
har en bekväm metod för att registrera slutet av reaktionen.
HCl + NaOH → NaCl + H2O
Huvuduppgiften för titrimetrisk analys är inte bara att använda en lösning med exakt känd koncentration (fixanal), utan också att korrekt bestämma ekvivalenspunkten.
Det finns flera sätt att fixa ekvivalenspunkten:
Baserat på den inneboende färgen på jonerna i elementet som bestäms, till exempel mangan i form av en anjonMnO 4 -
Enligt vittnesämnet
Exempel: Ag + + Cl - " AgCl $
Ag + + CrO 4 " Ag 2 CrO 4 $ (ljus orange färg)
En liten mängd salt K 2 CrO 4 (vittne) tillsätts i kolven där klorjonen ska bestämmas. Därefter tillsätts testämnet gradvis från byretten, varvid klorjoner reagerar först och en vit fällning (AgCl) bildas, dvs PR AgCl<< ПР Ag2Cr O4.
En extra droppe silvernitrat ger alltså en ljus orange färg, eftersom allt klor redan har reagerat.
III. Använda indikatorer: till exempel, under neutraliseringsreaktionen, används syra-basindikatorer: lackmus, fenolftalein, metylorange - organiska föreningar som ändrar färg när de går från en sur till en alkalisk miljö.
Indikatorer– organiska färgämnen som ändrar färg när surheten i miljön förändras.
Schematiskt (med utelämnande av mellanformer) kan indikatorns jämvikt representeras som en syra-basreaktion
HIn +H2O In - + H3O+
H2O  H + + OH -
H + + OH -
H++H2O  H3O+
H3O+
Färgövergångsområdet för indikatorn (position och intervall) påverkas av alla faktorer som jämviktskonstanten beror på (jonstyrka, temperatur, främmande ämnen, lösningsmedel), såväl som indikatorn.
Klassificering av titrimetriska analysmetoder.
syra-bas titrering (neutralisering): denna metod bestämmer mängden syra eller alkali i den analyserade lösningen;
utfällning och komplexbildning (argentometri)
Ag + + Cl - " AgCl $
redoxtitrering (redoximetri):
a) permanganatometry (KMnO4);
b) jodometri (Y2);
c) bromometri (KBr03);
d) dikromatometri (K2Cr207);
e) cerimetri (Ce(SO4)2);
e) vanadometri (NH4VO3);
g) titanometri (TiCl 3), etc.
Titrimetrisk analys (volymanalys) är en metod för kvantitativ analys baserad på att mäta volymen eller massan av reagenset som krävs för reaktionen med ämnet som studeras. Titrimetrisk analys används i stor utsträckning i biokemiska, kliniska, sanitära och hygieniska och andra laboratorier i experimentella studier och för kliniska analyser. Till exempel, vid fastställande av syra-basbalans, bestämning av surheten i magsaft, surhet och alkalinitet i urin, etc. Titrimetrisk analys fungerar också som en av de viktigaste metoderna för kemisk analys i kontroll- och analytiska farmaceutiska laboratorier.
Mängden av testämnet i en titrimetrisk analys bestäms genom titrering: en lösning av ett annat ämne med känd koncentration tillsätts gradvis till en exakt uppmätt volym av en lösning av testämnet tills dess mängd blir kemiskt ekvivalent med mängden testet ämne. Tillståndet för ekvivalens kallas titreringsekvivalenspunkten. En lösning av ett reagens med känd koncentration som används för titrering kallas en titrerad lösning (standardlösning eller titrering): den exakta koncentrationen av den titrerade lösningen kan uttryckas med titer (g/ml), normalitet (eq/l), etc.
Följande krav ställs på reaktioner som används vid titrimetrisk analys: ämnen måste reagera i strikt kvantitativa (stökiometriska) förhållanden utan sidoreaktioner, reaktioner måste fortgå snabbt och nästan till fullo; För att fastställa ekvivalenspunkten är det nödvändigt att använda tillräckligt tillförlitliga metoder. Dessutom är det önskvärt att vid titrimetrisk analys sker reaktionerna vid rumstemperatur.
Ekvivalenspunkten i en titrimetrisk analys bestäms av en förändring i färgen på den titrerade lösningen eller indikatorn som introduceras i början eller under titreringen, en förändring i lösningens elektriska ledningsförmåga, en förändring i potentialen hos elektroden nedsänkt i titrerad lösning, en förändring av strömvärdet, optisk densitet, etc.
En av de mycket använda metoderna för att fastställa ekvivalenspunkten är indikatormetoden. Indikatorer är ämnen som gör det möjligt att fastställa slutpunkten för titreringen (ögonblicket för en skarp förändring av färgen på den titrerade lösningen). Oftast tillsätts en indikator till hela lösningen som titreras (intern indikator). När du arbetar med externa indikatorer, ta med jämna mellanrum en droppe av den titrerade lösningen och blanda den med en droppe av indikatorlösningen eller placera den på indikatorpapper (vilket leder till förlust av analyten).
Titreringsprocessen avbildas grafiskt i form av titreringskurvor, som låter dig visualisera hela titreringsförloppet och välja den indikator som är mest lämpad för att få exakta resultat, eftersom Titreringskurvan kan jämföras med intervallet för färgändring av indikatorn.
Fel i titrimetrisk analys kan vara metodologiska och specifika på grund av egenskaperna hos en given reaktion. Metodiska fel är förknippade med titreringsmetodens egenheter och beror på mätinstrumentens fel, kalibrering av volumetriska glasvaror, pipetter, byretter och ofullständig svällning av vätskor längs väggarna på mätglasvarorna.
Specifika fel beror på egenskaperna hos en given reaktion och beror på reaktionens jämviktskonstant och på noggrannheten i att detektera ekvivalenspunkten. farmaceutisk medicin molekyl analgin
Metoder för titrimetrisk analys, beroende på reaktionerna som ligger till grund för dem, är indelade i följande huvudgrupper:
- 1. Neutraliseringsmetoder, eller syra-bastitrering, är baserade på neutraliseringsreaktioner, d.v.s. på växelverkan mellan syror och baser. Dessa metoder inkluderar acidimetri (kvantifiering av baser med titrerade lösningar av syror), alkalimetri (bestämning av syror med titrerade lösningar av baser), halometri (kvantifiering av salter med baser eller syror om de reagerar med salter i stökiometriska förhållanden).
- 2. Utfällningsmetoder bygger på titrering av ämnen som bildar olösliga föreningar i en viss miljö, till exempel bariumsalter, silver, bly, zink, kadmium, kvicksilver (II), koppar (III), etc. Dessa metoder inkluderar argentometri (titrering med en nitratlösning silver), kvicksilverometri (titrering med en lösning av kvicksilvernitrat), etc.
- 3. Metoder för komplexbildning, eller komplexometri (kvicksilvermetri, fluorometri, etc.), är baserade på användningen av reaktioner där komplexa föreningar bildas, till exempel Ag+ + 2CN- ы Ag (CN)2]. Komplexeringsmetoder är nära besläktade med nederbördsmetoder, eftersom Många utfällningsreaktioner åtföljs av komplexbildning, och bildningen av komplex åtföljs av utfällning av svårlösliga föreningar.
- 4. Oxidationsmetoder - reduktion, eller oxidimetri, inkluderar permanganatometry, kromatometri (bikromatometri), jodometri, bromometri, cerimetri, vanadometri, etc.
Titrimetrisk analys baseras på den exakta mätningen av mängden reagens som förbrukas i reaktionen med ämnet som bestäms. Tills nyligen kallades denna typ av analys vanligtvis volymetrisk på grund av att det vanligaste sättet i praktiken att mäta mängden av ett reagens var att mäta volymen lösning som förbrukades i reaktionen. Nuförtiden förstås volymetrisk analys som en uppsättning metoder baserade på att mäta volymen av flytande, gas eller fasta faser.
Namnet titrimetrisk är associerat med ordet titer, vilket indikerar koncentrationen av lösningen. Titern visar antalet gram löst ämne i 1 ml lösning.
En titrerad eller standardlösning är en lösning vars koncentration är känd med hög noggrannhet. Titrering är tillsatsen av en titrerad lösning till den som analyseras för att bestämma en exakt ekvivalent mängd. Titreringslösningen kallas ofta för arbetslösningen eller titreringslösningen. Till exempel, om en syra titreras med en alkali, kallas alkalilösningen en titrering. Titreringspunkten när mängden tillsatt titrering är kemiskt ekvivalent med mängden av det titrerade ämnet kallas ekvivalenspunkten.
Reaktioner som används i titrimetri måste uppfylla följande grundläggande krav:
1) reaktionen måste fortgå kvantitativt, dvs. jämviktskonstanten för reaktionen måste vara tillräckligt stor;
2) reaktionen måste fortgå med hög hastighet;
3) reaktionen bör inte kompliceras av biverkningar;
4) det måste finnas ett sätt att bestämma slutet av reaktionen.
Om en reaktion inte uppfyller minst ett av dessa krav kan den inte användas i titrimetrisk analys.
Inom titrimetri finns direkta, omvända och indirekta titreringar.
Vid direkttitreringsmetoder reagerar analyten direkt med titreringen. För att utföra analys med denna metod räcker det med en fungerande lösning.
Backtitreringsmetoder (eller, som de också kallas, resttitreringsmetoder) använder två titrerade arbetslösningar: en huvudlösning och en hjälplösning. Till exempel är tillbakatitrering av kloridjoner i sura lösningar allmänt känd. Först tillsätts ett känt överskott av en titrerad lösning av silvernitrat (den huvudsakliga arbetslösningen) till den analyserade kloridlösningen. I detta fall sker en reaktion för att bilda lätt löslig silverklorid.
Överskottsmängden AgNO 3 som inte har reagerat titreras med en lösning av ammoniumtiocyanat (hjälp-arbetslösning).
Den tredje huvudtypen av titrimetrisk bestämning är titrering av en substituent, eller titrering genom substitution (indirekt titrering). I denna metod tillsätts ett speciellt reagens till ämnet som bestäms, som reagerar med det. En av reaktionsprodukterna titreras sedan med arbetslösningen. Till exempel, under den jodometriska bestämningen av koppar, tillsätts ett avsiktligt överskott av KI till den analyserade lösningen. Reaktionen 2Cu2+ +4I - =2CuI+ I2 inträffar. Det frigjorda jodet titreras med natriumtiosulfat.
Det finns också den så kallade omvända titreringen, där en standardreagenslösning titreras med den analyserade lösningen.
Beräkningen av titrimetriska analysresultat bygger på likvärdighetsprincipen, enligt vilken ämnen reagerar med varandra i ekvivalenta mängder.
För att undvika motsägelser rekommenderas att alla syra-basreaktioner reduceras till en enda gemensam bas, som kan vara en vätejon. I redoxreaktioner är det lämpligt att relatera mängden reaktant till antalet elektroner som accepteras eller doneras av ämnet i en given halvreaktion. Detta tillåter oss att ge följande definition.
En ekvivalent är en verklig eller fiktiv partikel som kan fästa, frigöra eller på annat sätt vara likvärdig med en vätejon i syra-basreaktioner eller en elektron i redoxreaktioner.
När man använder termen "ekvivalent" är det alltid nödvändigt att ange vilken specifik reaktion det avser. Motsvarigheten till ett givet ämne är inte ett konstant värde, utan beror på stökiometrin för reaktionen som de deltar i.
Vid titrimetrisk analys används reaktioner av olika slag: - syra-basinteraktion, komplexbildning etc. som uppfyller kraven för titrimetriska reaktioner. Den typ av reaktion som inträffar under titreringen ligger till grund för klassificeringen av titrimetriska analysmetoder. Typiskt särskiljs följande titrimetriska analysmetoder.
1. Metoder för syra-bas-interaktion är förknippade med processen för protonöverföring:
2. Komplexbildningsmetoder använder reaktioner för bildning av koordinationsföreningar:
3. Utfällningsmetoder är baserade på bildningsreaktioner av svårlösliga föreningar:
4. Oxidationsreduktionsmetoder kombinerar en stor grupp redoxreaktioner:
Vissa titrimetriska metoder är namngivna efter typen av huvudreaktion som inträffar under titreringen eller efter titreringsnamnet (till exempel i argentometriska metoder är titranten en AgNO 3-lösning, i permanganatometriska metoder - en KMn0 4-lösning, etc.).
Titreringsmetoder kännetecknas av hög noggrannhet: bestämningsfelet är 0,1 - 0,3%. Fungerande lösningar är stabila. En mängd olika indikatorer finns tillgängliga för att indikera ekvivalenspunkten. Bland titrimetriska metoder baserade på komplexbildningsreaktioner är reaktioner med komplexoner av största vikt. Nästan alla katjoner bildar stabila koordinationsföreningar med komplexoner, därför är komplexometriska metoder universella och tillämpbara för analys av ett brett spektrum av olika objekt.
Syra-bastitreringsmetoden är baserad på reaktionsreaktioner mellan syror och baser, det vill säga neutraliseringsreaktioner:
H + + OH - ↔ H2O
Metodens arbetslösningar är lösningar av starka syror (HCl, H 2 S, HNO3, etc.) eller starka baser (NaOH, KOH, Ba(OH) 2, etc.). Beroende på titreringen är syra-bastitreringsmetoden indelad i acidimetri , om titranten är en sur lösning, och alkalimetri , om titranten är en lösning av en bas.
Arbetslösningar framställs huvudsakligen som sekundära standardlösningar, eftersom utgångsmaterialen för deras framställning inte är standard, och sedan standardiseras de mot standardämnen eller standardlösningar. Till exempel: sura lösningar kan standardiseras enligt standardämnen- natriumtetraborat Na2B4O7∙10H2O, natriumkarbonat Na2CO3∙10H2O eller standardlösningar av NaOH, KOH; och baslösningar - med användning av oxalsyra H 2 C 2 O 4 ∙ H 2 O, bärnstenssyra H 2 C 4 H 4 O 4 eller standardlösningar av HCl, H 2 SO 4, HNO 3.
Ekvivalenspunkt och titreringsslutpunkt. Enligt likvärdighetsregeln ska titreringen fortsätta tills mängden tillsatt reagens blir likvärdig med innehållet av ämnet som bestäms. Det ögonblick under titreringsprocessen när mängden av en standardreagenslösning (titrant) blir teoretiskt strikt ekvivalent med mängden av ämnet som bestäms enligt en viss kemisk reaktionsekvation kallas Ekvivalenspunkten .
Ekvivalenspunkten bestäms på olika sätt, till exempel genom att ändra färgen på indikatorn som tillsätts till den titrerade lösningen. Det ögonblick då en observerad förändring i färgen på indikatorn inträffar kallas slutpunkt för titrering. Mycket ofta sammanfaller inte slutpunkten för titreringen exakt med ekvivalenspunkten. Som regel skiljer de sig från varandra med högst 0,02-0,04 ml (1-2 droppar) titrant. Detta är mängden titrant som är nödvändig för att interagera med indikatorn.
Skicka ditt goda arbete i kunskapsbasen är enkelt. Använd formuläret nedan
Studenter, doktorander, unga forskare som använder kunskapsbasen i sina studier och arbete kommer att vara er mycket tacksamma.
Postat på http://www.allbest.ru/
Planen
1. Kärnan i nederbördstitrering
2. Argentometrisk titrering
3. Tiocyanatometrisk titrering
4. Tillämpning av fällningstitrering
4.1 Beredning av en standardiserad lösning av silvernitrat
4.2 Beredning av standardiserad ammoniumtiocyanatlösning
4.3 Bestämning av klorhalt i ett prov enligt Volhard
4.4 Bestämning av natriumtrikloracetathalt i en teknisk beredning
1. Kärnan i nederbördtitrering
Metoden kombinerar titrimetriska bestämningar baserade på bildningsreaktioner av svårlösliga föreningar. Endast vissa reaktioner som uppfyller vissa villkor är lämpliga för dessa ändamål. Reaktionen måste fortgå strikt enligt ekvationen och utan sidoprocesser. Den resulterande fällningen måste vara praktiskt taget olöslig och falla ut ganska snabbt, utan bildning av övermättade lösningar. Dessutom är det nödvändigt att kunna bestämma slutpunkten för titreringen med hjälp av en indikator. Slutligen måste fenomenen med adsorption (samfällning) uttryckas under titreringen så svagt att resultatet av bestämningen inte förvrängs.
Namnen på enskilda utfällningsmetoder kommer från namnen på de lösningar som används. Metoden som använder en lösning av silvernitrat kallas argentometri. Denna metod bestämmer innehållet av C1~ och Br~joner i neutrala eller svagt alkaliska medier. Tiocyanatometri är baserad på användningen av en lösning av ammoniumtiocyanat NH 4 SCN (eller kalium KSCN) och tjänar till att bestämma spår av C1- och Br~, men i starkt alkaliska och sura lösningar. Det används också för att bestämma silverhalten i malmer eller legeringar.
Den dyra argentometriska metoden för att bestämma halogener ersätts successivt med en mercurometrisk metod. I den senare används en lösning av kvicksilver (I) nitrat Hg 2 (NO 3) 2.
Låt oss överväga argentometriska och tiocyanatometriska titreringar mer i detalj.
2. Argentometrisk titrering
Metoden är baserad på reaktionen av utfällning av C1~ och Br~joner av silverkatjoner med bildning av svårlösliga halogenider:
Cl-+Ag+=AgClb Br^- + Ag+= AgBr
I detta fall används en lösning av silvernitrat. Om ett ämne analyseras för silverhalt, används en lösning av natrium (eller kalium)klorid. titreringslösning läkemedel
Titreringskurvor är av stor betydelse för att förstå argentometrimetoden. Som ett exempel, överväg fallet med titrering av 10,00 ml av 0,1 N. natriumkloridlösning 0,1 N. lösning av silvernitrit (utan att ta hänsyn till förändringar i lösningens volym).
Innan titreringen börjar är koncentrationen av kloridjoner i lösningen lika med den totala koncentrationen av natriumklorid, dvs 0,1 mol/l eller = --lg lO-i = 1.
När 9,00 ml silvernitratlösning tillsätts till en titrerad lösning av natriumklorid och 90 % av kloridjonerna fälls ut, minskar deras koncentration i lösningen 10 gånger och blir lika med N0~2 mol/l, och pCl blir lika med till 2. Eftersom värdet nPAgci= IQ- 10 blir koncentrationen av silverjoner:
10-yu/[C1-] = Yu-Yu/10-2 = 10-8 M ol/l, ELLER pAg= -- lg = -- IglO-s = 8.
Alla andra punkter för att konstruera titreringskurvan beräknas på liknande sätt. Vid ekvivalenspunkten pCl=pAg= = 5 (se tabell).
Tabellförändringar i pC\ och pAg under titrering av 10,00 ml 0,1 N. natriumkloridlösning 0,1 N. silvernitratlösning
|
AgNO3-lösning tillsattes, |
|||||
|
9,99 10,00 (ekv. poäng) 10,01 |
yu-4 yu-5 yu-6. |
yu- 6 yu- 5 yu-* |
|||
Hoppintervallet under argentometrisk titrering beror på koncentrationen av lösningar och på värdet av löslighetsprodukten av fällningen. Ju mindre PR-värde för föreningen som erhålls som ett resultat av titrering, desto bredare hoppintervall på titreringskurvan och desto lättare är det att registrera slutpunkten för titreringen med hjälp av en indikator.
Den vanligaste argentometriska bestämningen av klor är Mohr-metoden. Dess essens består i direkt titrering av vätskan med en lösning av silvernitrat med indikatorn kaliumkromat tills den vita fällningen blir brun.
Indikatorn för Mohrs metod - en lösning av K2CrO 4 med silvernitrat ger en röd fällning av silverkromat Ag 2 CrO 4, men fällningens löslighet (0,65-10~ 4 E/l) är mycket större än lösligheten för silver klorid (1,25X_X10~5 E/1). Därför, vid titrering med en lösning av silvernitrat i närvaro av kaliumkromat, uppträder en röd fällning av silverkromat först efter tillsats av ett överskott av Ag+-joner, när alla kloridjoner redan har fällts ut. I det här fallet tillsätts alltid en lösning av silvernitrat till vätskan som analyseras, och inte vice versa.
Möjligheterna att använda argentometri är ganska begränsade. Det används endast vid titrering av neutrala eller svagt alkaliska lösningar (pH från 7 till 10). I en sur miljö löses silverkromatfällningen.
I starkt alkaliska lösningar sönderfaller silvernitrat med frigörande av olöslig oxid Ag 2 O. Metoden är också olämplig för att analysera lösningar som innehåller NH^-jonen, eftersom det i detta fall bildas ett ammoniakkomplex + med Ag + katjonen - Den analyserade lösningen bör inte innehålla Ba 2+, Sr 2+, Pb 2+, Bi 2+ och andra joner som fälls ut med kaliumkromat. Ändå är argentometri lämplig för att analysera färglösa lösningar som innehåller C1~- och Br_-joner.
3. Tiocyanatometrisk titrering
Tiocyanatometrisk titrering är baserad på utfällningen av Ag+ (eller Hgl+) joner med tiocyanater:
Ag+ + SCN- = AgSCN|
För bestämning krävs en lösning av NH 4 SCN (eller KSCN). Bestäm Ag+ eller Hgi+ genom direkt titrering med en tiocyanatlösning.
Tiocyanatometrisk bestämning av halogener utförs med den så kallade Volhard-metoden. Dess väsen kan uttryckas i diagram:
CI- + Ag+ (överskott) -* AgCI + Ag+ (rest), Ag+ (rest) + SCN~-> AgSCN
Med andra ord tillsätts ett överskott av en titrerad lösning av silvernitrat till vätskan som innehåller C1~. Därefter återtitreras AgNO3-resten med en tiocyanatlösning och resultatet beräknas.
Indikatorn för Volhard-metoden är en mättad lösning av NH 4 Fe(SO 4) 2 - 12H 2 O. Även om det finns Ag+-joner i den titrerade vätskan, är de tillsatta SCN~-anjonerna associerade med frisättningen av AgSCN-fällning, men gör det interagerar inte med Fe 3+ joner. Efter ekvivalenspunkten orsakar dock det minsta överskottet av NH 4 SCN (eller KSCN) bildandet av blodröda 2+ och + joner. Tack vare detta är det möjligt att bestämma motsvarande punkt.
Tiocyanatometriska bestämningar används oftare än argentometriska. Närvaron av syror stör inte titreringen med Volhard-metoden och bidrar till och med till att få mer exakta resultat, eftersom den sura miljön undertrycker hydrolysen av Fe-saltet**. Metoden gör det möjligt att bestämma C1~-jonen inte bara i alkalier utan även i syror. Bestämningen hämmas inte av närvaron av Ba 2+, Pb 2+, Bi 3+ och några andra joner. Men om den analyserade lösningen innehåller oxidationsmedel eller kvicksilversalter, blir användningen av Volhards metod omöjlig: oxidationsmedel förstör SCN-jonen och kvicksilverkatjonen fäller ut den.
Den alkaliska testlösningen neutraliseras före titrering med salpetersyra, annars kommer Fe 3 +-jonerna som ingår i indikatorn att fälla ut järn(III)hydroxid.
4. Tillämpningar av nederbördstitrering
4.1 Beredning av en standardiserad lösning av silvernitrat
De primära standarderna för att standardisera en silvernitratlösning är natrium- eller kaliumklorider. Bered en standardlösning av natriumklorid och cirka 0,02 N. silvernitratlösning, standardisera den andra lösningen till den första.
Framställning av en standardlösning av natriumklorid. En lösning av natriumklorid (eller kaliumklorid) framställs av kemiskt rent salt. Den ekvivalenta massan av natriumklorid är lika med dess molära massa (58,45 g/mol). Teoretiskt, för att förbereda 0,1 l 0,02 n. lösning kräver 58,45-0,02-0,1 = 0,1169 g NaCl.
Ta ett prov på cirka 0,12 g natriumklorid på en analytisk våg, överför det till en 100 ml mätkolv, lös upp, för volymen till märket med vatten och blanda väl. Beräkna titern och normalkoncentrationen av den ursprungliga natriumkloridlösningen.
Beredning: 100 ml cirka 0,02 N. silvernitratlösning. Silvernitrat är ett ont om reagens, och vanligtvis har dess lösningar en koncentration som inte är högre än 0,05 N. 0,02 n är ganska lämpligt för detta arbete. lösning.
Under argentometrisk titrering är den ekvivalenta massan av AgN03 lika med den molära massan, dvs 169,9 g/mol. Därför, 0,1 l 0,02 n. lösningen bör innehålla 169,9-0,02-0,1 = 0,3398 g AgNO 3. Det är dock ingen mening att ta exakt detta prov, eftersom kommersiellt silvernitrat alltid innehåller föroreningar. Väg cirka 0,34 - 0,35 g silvernitrat på en teknokemisk våg; Väg upp lösningen i en liten mängd vatten i en 100 ml mätkolv och justera volymen med vatten, slå in den i svart papper och häll den i en mörk glaskolv. Skölj pipetten med natriumkloridlösning och överför 10,00 ml av lösningen till en konisk kolv. Tillsätt 2 droppar av en mättad lösning av kaliumkromat och titrera försiktigt, droppe för droppe, med en lösning av silvernitrat under omrörning. Se till att färgen på blandningen ändras från gul till rödaktig på grund av en överflödig droppe silvernitrat. Efter att ha upprepat titreringen 2-3 gånger, ta medelvärdet av de konvergenta avläsningarna och beräkna den normala koncentrationen av silvernitratlösningen.
Låt oss anta att för titrering av 10,00 ml 0,02097 n. natriumkloridlösning användes i genomsnitt 10,26 ml silvernitratlösning. Sedan
A^ AgNOj. 10,26 = 0,02097. 10,00, AT AgNOs = 0,02097- 10,00/10,26 = 0,02043
Om det är avsett att bestämma innehållet av C1~ i provet, beräkna dessutom titern för silvernitratlösningen med avseende på klor: T, - = 35,46-0,02043/1000 = 0,0007244 g/ml, “l detta betyder att 1 ml silvernitratlösning motsvarar 0,0007244 g titrerat klor.
4.2 Framställning av en standardiserad ammoniumtiocyanatlösningjag
En lösning av NH 4 SCN eller KSCN med en exakt känd titer kan inte framställas genom att lösa upp ett prov, eftersom dessa salter är mycket hygroskopiska. Därför bereds en lösning med en ungefärlig normal koncentration och justeras till en standardiserad lösning av silvernitrat. Indikatorn är en mättad lösning av NH 4 Fe(SO 4) 2 - 12H 2 O. För att förhindra hydrolys av Fe-saltet tillsätts 6 N till själva indikatorn och till den analyserade lösningen före titrering. salpetersyra.
Beredning: 100 ml cirka 0,05 N. ammoniumtiocyanatlösning. Den ekvivalenta massan av NH4SCN är lika med dess molära massa, dvs 76,12 g/mol. Därför, 0,1 l 0,05 n. lösning bör innehålla 76.12.0.05-0.1=0.3806 g NH 4 SCN.
Ta ett prov på cirka 0,3-0,4 g på en analytisk våg, överför det till en 100 ml kolv, lös upp, för volymen av lösningen till märket med vatten och blanda.
Standardisering av ammoniumtiocyanatlösning med silvernitrat. Förbered en byrett för titrering med NH 4 SCN-lösning. Skölj pipetten med silvernitratlösningen och mät upp 10,00 ml av den i den koniska kolven. Tillsätt 1 ml NH4Fe(SO4)2-lösning (indikator) och 3 ml. 6 n. salpetersyra. Häll långsamt, under kontinuerlig skakning, i NH 4 SCN-lösningen från byretten. Stoppa titreringen efter uppkomsten av en brunrosa färg 2+, som inte försvinner vid kraftig skakning.
Upprepa titreringen 2-3 gånger, ta medelvärdet från de konvergerande avläsningarna och beräkna den normala koncentrationen av NH 4 SCN.
Låt oss anta att för titrering av 10,00 ml 0,02043 n. silvernitratlösning användes i genomsnitt 4,10 ml NH4SCN-lösning.
4.3 Definitioninnehållklor i provet enligt Volhard
Volhard halogener bestäms genom tillbakatitrering av silvernitratåterstoden med en lösning av NH4SCN. Men noggrann titrering är endast möjlig här om åtgärder vidtas för att förhindra (eller bromsa) reaktionen mellan silverklorid och överskott av järntiocyanat:
3AgCI + Fe (SCN)3 = SAgSCNJ + FeCl3
där färgen som uppträder först gradvis försvinner. Det är bäst att filtrera bort AgCl-fällningen innan överskottet silvernitrat titreras med NH 4 SCN-lösning. Men ibland tillsätts istället lite organisk vätska till lösningen, som inte blandas med vatten och som så att säga isolerar ApCl-fällningen från överskott av nitrat.
Bestämningsmetod. Ta ett provrör med en lösning av analyten som innehåller natriumklorid. Lös upp ett prov av ämnet i en 100 ml mätkolv och för volymen av lösningen till märket med vatten (kloridkoncentrationen i lösningen bör inte vara mer än 0,05 N).
Pipettera 10,00 ml av testlösningen till en konisk kolv, tillsätt 3 ml 6 N. salpetersyra och häll i ett känt överskott av AgNO 3-lösning från byretten, till exempel 18,00 ml. Filtrera sedan bort silverkloridfällningen. Titrera det återstående silvernitratet med NH 4 SCN-lösning enligt beskrivningen i föregående stycke. Efter att ha upprepat bestämningen 2-3 gånger, ta medelvärdet. Om silverkloridfällningen har filtrerats, bör den tvättas och tvättvattnet tillsättas till filtratet.
Låt oss anta att provets vikt var 0,2254 g Till 10,00 ml av den analyserade lösningen tillsattes 18,00 ml 0,02043 N. silvernitratlösning. För att titrera överskottet användes 5,78 ml * 0,04982 N. NH 4 SCN-lösning.
Först och främst, låt oss beräkna vilken volym som är 0,02043 n. lösning av silvernitrat motsvarar 5,78 ml 0,04982 N förbrukad på titrering. NH 4 SCN-lösning:
därför användes 18,00 - 14,09 = 3,91 ml 0,2043 N för att fälla ut C1~-jonen. silvernitratlösning. Härifrån är det lätt att hitta den normala koncentrationen av natriumkloridlösning.
Eftersom den ekvivalenta massan av klor är 35,46 g/mol,* är den totala massan av klor i provet:
772=0,007988-35,46-0,1 =0,02832 g.
0,2254 g C1-- 100 %
x = 0,02832-100/0,2254 = 12,56 %:
0,02832 > C1 -- x %
Volhardmetoden används också för att bestämma innehållet av Br~ och I-joner. I detta fall är det inte nödvändigt att filtrera bort fällningarna av silverbromid eller jodid. Men det måste tas med i beräkningen att Fe 3 + -jonen oxiderar jodider till fri jod. Därför tillsätts indikatorn efter att alla I-joner har fällts ut av silvernitrat.
4.4 Bestämning av trichlhaltOnatriumracetat| vid teknisk beredning (för klor)
Tekniskt natriumtrikloracetat (TCA) är en herbicid för att döda ogräs från spannmål. Det är ett vitt eller ljusbrunt kristallint ämne, mycket lösligt i vatten. Enligt Volhard bestäms först massfraktionen av organiska kloridföreningar, och sedan efter förstörelsen av klor. Från skillnaden hittas massfraktionen (%) av natriumtrikloracetatklor.
Bestämning av massfraktionen (%) av oorganiska klorföreningar. Placera en exakt vägd del av läkemedlet (2-2,5 g) i en 250 ml mätkolv, lös upp, för lösningen till märket med vatten och blanda. Pipettera 10 ml lösning till en konisk kolv och tillsätt 5-10 ml koncentrerad salpetersyra.
Tillsätt 5 eller 10 ml 0,05 N från byretten. silvernitratlösning och titrera överskottet med 0,05 N. en lösning av NH4SCN i närvaro av NH4Fe(SO4)2 (indikator).
Beräkna massandelen (%) av klor (x) av oorganiska föreningar med hjälp av formeln
(V -- l/i) 0,001773-250x100
där V är volymen exakt 0,05 N. AgNO 3-lösning tas för analys; Vi -- volym exakt 0,05 N. NH4SCN-lösning, använd för titrering av överskott av AgNO3; t—ett prov av natriumtrikloracetat; 0,001773 -- klormassa motsvarande 1 ml 0,05 N. AgNO-lösning. Bestämning av massandel (%) av totalt klor. Ta 10 ml av den tidigare beredda lösningen i en konisk kolv, tillsätt 10 ml av en lösning med en massfraktion av NaOH 30% och 50 ml vatten. Anslut kolven till en återloppskylare och koka dess innehåll i 2 timmar. Låt vätskan svalna, skölj kondensorn med vatten och samla upp tvättvattnet i samma kolv. Tillsätt 20 ml utspädd (1:1) salpetersyra till lösningen och tillsätt 30 ml 0,05 N från en byrett. silvernitratlösning. Titrera överskottet av silvernitrat till 0,05 N. en lösning av NH4SCN i närvaro av NH4Fe(SO4)2. Beräkna massandelen (%) av totalt klor (xi) med hjälp av formeln ovan. Hitta massfraktionen (%) av natriumtrikloracetat i beredningen (x^) med hjälp av formeln
x2 = (x1 -- x) (185,5/106,5),
där 185,5 är den molära massan av natriumtrikloracetat; 106,5 -- massa klor som ingår i molmassan av natriumtrikloracetat.
Postat på Allbest.ru
...Liknande dokument
Kärnan och klassificeringen av syra-bas titreringsmetoder, användning av indikatorer. Funktioner av komplexometrisk titrering. Analys av nederbördstitreringsmetoder. Detektering av titreringsslutpunkt. Begreppet argenometri och ticyanometri.
test, tillagt 2011-02-23
Sekvensen för att beräkna titreringskurvan för en lösning av saltsyra med en lösning av en svag bas av ammoniumhydroxid. Konstruktion av en titreringskurva, bestämning av ekvivalenspunkten och direkt neutralitet. Välja en indikator och beräkna dess fel.
test, tillagt 2016-03-01
Bestämning av halten av alkalinitetsbärare i natriumkarbonatlösning genom direkt syra-bastitrering. Matematiskt uttryck för lagen om ekvivalenter. Konstruktion av integrerade och differentiella potentiometriska titreringskurvor.
laboratoriearbete, tillagt 2012-02-15
Koncept och typer av titrimetrisk analys. Egenskaper för komplexbildare och indikatorer. Beredning av en titrerad lösning för komplexometrisk titrering. Metoder för att studera aluminium, vismut, bly, magnesium, zink.
kursarbete, tillagt 2013-01-13
Potentiometrisk titreringsmetod. Syra-bas titrering. Bestämning av slutpunkten för titreringen. Metod för att utföra potentiometrisk titrering. Potentiometrisk titrering, använda instrument och bearbetning av analysresultat.
kursarbete, tillagt 2008-06-24
Klassificering av redoxtitreringsmetoder. Faktorer som påverkar reaktionshastigheten. Specifika och redoxindikatorer. Kärnan i permanganatometry, jodometri, dikromatometri. Beredning av kaliumdikromatlösning.
presentation, tillagd 2015-03-19
Beräkning av indikatorfel för utvalda indikatorer, titreringskurva på 25 ml 0,05 M CH3COOH-lösning med 0,05 M KOH-lösning. Syra-basindikatorer. Titreringsstadier: startpunkt, område före punkten och område efter ekvivalenspunkten.
test, tillagt 2013-12-18
Funktioner hos redoxtitreringsmetoder. Grundläggande krav på reaktioner, jämviktskonstant. Egenskaper för typer av redoxtitrering, dess indikatorer och kurvor. Förberedelse och standardisering av lösningar.
kursarbete, tillagd 2014-12-25
Begreppet titrametrisk analys. Redoxtitrering, dess typer och reaktionsförhållanden. Beräkning av titreringskurvpunkter, potentialer, konstruktion av en titreringskurva. Val av indikator, beräkning av indikatortitreringsfel.
kursarbete, tillagt 2012-10-06
Klassificering av titrametriska analysmetoder. Kärnan i "neutraliseringsmetoden". Utarbetande av fungerande lösningar. Beräkning av poäng och konstruktion av syra-bas- och redoxtitreringskurvor. Fördelar och nackdelar med jodometri.
Introduktion
Laboratorieworkshopen genomförs efter att ha studerat den teoretiska kursen ”Analytisk kemi och fysikalisk kemisk analys” och tjänar till att befästa och fördjupa de förvärvade kunskaperna.
Uppgiften med kvantitativ analys är att bestämma mängden (innehållet) av grundämnen (joner), radikaler, funktionella grupper, föreningar eller faser i det analyserade objektet. Denna kurs behandlar de grundläggande metoderna för titrimetrisk (volumetrisk) analys, titreringsmetoder och deras praktiska tillämpningar.
Innan laboratoriearbete påbörjas genomgår eleverna säkerhetsinstruktioner. Innan varje arbete genomförs ska studenten klara ett kollokvium om de avsnitt som läraren angett, samt om analysmetodiken. För att göra detta behöver du:
1) upprepa den relevanta delen av kursen;
2) bli bekant med arbetsmetodik i detalj;
3) upprätta ekvationer av kemiska reaktioner som ligger till grund för den kemiska analys som genomförs;
4) studera egenskaperna i analysen ur säkerhetssynpunkt.
Baserat på resultatet av sitt arbete gör eleverna en rapport som ska ange:
· jobbtitel;
· Mål;
· Metodens teoretiska grund: metodens väsen, grundläggande ekvation, beräkningar och konstruktion av titreringskurvor, val av indikator;
· reagenser och utrustning som används under arbetet;
· analysteknik:
Förberedelse av primära standarder;
Förberedelse och standardisering av fungerande lösning;
Bestämning av innehållet av testämnet i lösning;
· experimentella data;
· statistisk bearbetning av analysresultat;
· Slutsatser.
TITRIMETRISKA ANALYSMETODER
Titrimetrisk analysmetod baseras på att mäta volymen av ett reagens med exakt känd koncentration (titrant) som spenderas på en kemisk reaktion med ämnet som bestäms.
Bestämningsproceduren (titrering) består av att tillsätta en titrering droppvis från en byrett till en exakt känd volym av en lösning av analyten med en okänd koncentration tills ekvivalenspunkten uppnås.
Var X– Ämne som ska bestämmas. R- titrant, P– reaktionsprodukt.
Ekvivalenspunkt (dvs.)- detta är det teoretiska tillståndet för lösningen som uppstår vid tillsatsen av en ekvivalent mängd titrant R till analyten X. I praktiken tillsätts titranten till analyten tills den når slutpunkten för titreringen (e.t.t.), vilket förstås i den visuella indikeringen av ekvivalenspunkten som det ögonblick då färgen på indikatorn som tillsätts till lösningen ändras. Utöver visuell indikering kan ekvivalenspunkten registreras med hjälp av instrument. I detta fall förstås slutpunkten för titreringen (titreringens slutpunkt) som ögonblicket för en skarp förändring av en fysisk kvantitet som uppmätts under titreringsprocessen (strömstyrka, potential, elektrisk konduktivitet, etc.).
Den titrimetriska analysmetoden använder följande typer av kemiska reaktioner: neutraliseringsreaktioner, oxidations-reduktionsreaktioner, utfällningsreaktioner och komplexbildningsreaktioner.
Beroende på vilken typ av kemisk reaktion som används särskiljs följande: titrimetriska analysmetoder:
– syra-bas titrering;
– fällningstitrering;
– komplexometrisk titrering eller komplexometri;
– redoxtitrering eller redoximetri.
Reaktionerna som används i den titrimetriska analysmetoden kräver följande: krav:
· reaktionen måste fortgå i stökiometriska förhållanden, utan sidoreaktioner;
· reaktionen måste fortgå nästan irreversibelt (≥ 99,9%), jämviktskonstanten för reaktionen K p >10 6, de resulterande fällningarna måste ha löslighet S < 10 -5 моль/дм 3 , а образующиеся комплексы – К уст > 10 -6 ;
· reaktionen måste fortgå med en tillräckligt hög hastighet;
· reaktionen måste ske vid rumstemperatur;
· Ekvivalenspunkten måste fastställas tydligt och tillförlitligt på något sätt.
Titreringsmetoder
I varje titrimetrisk analysmetod finns det flera titreringsmetoder. Skilja på framåttitrering, bakåttitrering och förskjutningstitrering .
Direkt titrering– titranten tillsätts droppvis till lösningen av analyten tills ekvivalenspunkten uppnås.
Titreringsschema: X + R = P.
Ekvivalentlagen för direkt titrering:
C (1/z) XV X = C (1/z) RVR. (2)
Mängden (massan) av analyten i testlösningen beräknas med hjälp av ekvivalentlagen (för direkt titrering)
m X = C (1/z) R V R M (1/z) X٠10 -3 , (3)
Var C (1/z) R– molär koncentration av titrantekvivalent, mol/dm 3 ;
V R– titreringsvolym, cm3;
M ( 1/ z) X– molmassan av ekvivalenten av det ämne som bestäms.
C (1/z) X– Molär koncentration av ekvivalenten av analyten, mol/dm 3 .
V X– volymen av ämnet som bestäms, cm3.
Ryggtitrering– två titranter används. I början
Den exakta volymen av den första titranten tillsätts till lösningen som analyseras ( R 1), tagit i överskott. Återstoden av den oreagerade titranten R1 titreras med en andra titrant ( R 2). Titrant kvantitet R 1, spenderade
för interaktion med analyten ( X bestäms av skillnaden mellan den tillsatta volymen titrant R 1 (V 1 30 volym R 2 (V 2) spenderas på titrering av den återstående titreringen R 1.
Titreringsschema: X + R 1 fast överskott = P 1 (R 1 resten).
R 1 resten + R 2 = P2.
Vid användning av bakåttitrering skrivs ekvivalentlagen enligt följande:
Analytens massa vid tillbakatitrering beräknas med hjälp av formeln
Den omvända titreringsmetoden används i de fall där det är omöjligt att välja en lämplig indikator för en direkt reaktion eller den fortsätter med kinetiska svårigheter (låg kemisk reaktionshastighet).
Titrering genom substitution (indirekt titrering)– används i fall där direkt eller omvänd titrering av analyten är omöjlig eller svår, eller när en lämplig indikator inte finns tillgänglig.
Till analyten X tillsätt lite reagens A i överskott, vid interaktion med vilken en ekvivalent mängd av ämnet frigörs R. Därefter reaktionsprodukten R titrera med en lämplig titrering R.
Titreringsschema: X + Aöverskott = P1.
P 1 + R = P2.
Ekvivalentlagen för titrering genom substitution är skriven enligt följande:
Eftersom antalet ekvivalenter av analyten är X och reaktionsprodukt Rär desamma, beräknas beräkningen av analytens massa vid indirekt titrering med hjälp av formeln
m X = C (1/z) R V R M (1/z) X٠10 -3 . (7)
Reagenser
1. Bärnstenssyra H 2 C 4 H 4 O 4 (reagenskvalitet) – primär standard.
2. Natriumhydroxid-NaOH-lösning med molär koncentration
~2,5 mol/dm 3
3. H2O destillerad.
Utrustning eleverna beskriver på egen hand.
Arbetsprocess:
1. Framställning av den primära standarden för bärnstenssyra HOOCCH 2 CH 2 COOH.
Bärnstenssyra framställs i en volym av 200,00 cm 3 med en molär koncentration av motsvarande ![]() mol/dm 3 .
mol/dm 3 .
![]() g/mol.
g/mol.
Reaktionsekvation:
Ta ett prov (vägning):
![]()
Dragvikt
Vägde kvantitativtöverförs till en mätkolv ( ![]() cm 3), tillsätt 50 - 70 cm 3 destillerat vatten, rör om tills bärnstenssyra är helt upplöst, justera till märket med destillerat vatten
cm 3), tillsätt 50 - 70 cm 3 destillerat vatten, rör om tills bärnstenssyra är helt upplöst, justera till märket med destillerat vatten
och blanda noga.
räkna med
enligt formeln

Reagenser
1. Natriumkarbonat Na 2 CO 3 (reagenskvalitet) – primär standard.
2. H2O destillerad.
3. Saltsyra-HCl-koncentration 1:1 (r=1,095 g/cm3).
4. Syra-bas-indikator (vald enligt titreringskurvan).
5. Blandad indikator - metylorange och metylenblått.
Arbetsprocess:
1. Framställning av primär standard natriumkarbonat (Na 2 CO 3).
En natriumkarbonatlösning framställs med en volym av 200,00 cm 3 med en molär koncentration av motsvarande ![]() mol/dm 3 .
mol/dm 3 .
Beräkning av provets massa, g: (massan tas exakt till fjärde decimalen).
Reaktionsekvationer:
1) Na2CO3 + HCl = NaHCO3 + NaCl
2) NaHCO3 + HCl = NaCl + H2O + CO2
_____________________________________
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
H 2 CO 3 – svag syra (K a1= 10 -6,35, K a2 = 10 -10,32).
Ta ett prov (vägning):
Vikt på klockglas (glas)
Vikt av urglas (glas) med vikt ![]()
Dragvikt
Vägde kvantitativtöverförs till en mätkolv ( ![]() cm 3), tillsätt 50 - 70 cm 3 destillerat vatten, blanda tills natriumkarbonat är helt upplöst, justera till märket med destillerat vatten
cm 3), tillsätt 50 - 70 cm 3 destillerat vatten, blanda tills natriumkarbonat är helt upplöst, justera till märket med destillerat vatten
och blanda noga.
Faktisk koncentration av den primära standarden räkna med
enligt formeln

2. Beredning och standardisering av titrant (HCl-lösning)
En lösning av saltsyra framställs med en volym av cirka 500 cm3
med en molär koncentrationsekvivalent på cirka 0,05÷0,06 mol/dm 3)
Titrant - en lösning av saltsyra med en ungefärlig koncentration av 0,05 mol/dm 3 framställs av saltsyra utspädd 1:1 (r = 1,095 g/cm 3).
Standardisering av lösningen HCl utförs enligt den primära standarden Na 2 CO 3 genom direkt titrering, med användning av pipetteringsmetoden.
Indikatorn väljs enligt titreringskurvan för natriumkarbonat med saltsyra (fig. 4).

Ris. 4. Titreringskurva för 100,00 cm 3 Na 2 CO 3 lösning med MED= 0,1000 mol/dm 3 HCl-lösning med C1/z= 0,1000 mol/dm 3
När du titrerar till den andra ekvivalenspunkten, använd indikatorn metylorange, 0,1 % vattenlösning (pT = 4,0). Ändring i färg från gul till orange (färgad terosa). Övergångsintervall
(pH = 3,1 - 4,4).
Schema 3. Standardisering av HCl-lösning

Placera en 25,00 cm 3 alikvot av en standardlösning av Na 2 CO 3 (med pipett) i en konisk titreringskolv med en kapacitet på 250 cm 3, tillsätt 2–3 droppar metylorange, späd med vatten till 50–75 cm 3 och titrera med en lösning av saltsyra tills färgen ändras från gul till "terosa" färg med en droppe titrant. Titrering utförs i närvaro av ett "vittne" (en stamlösning av Na 2 CO 3 med en indikator). Titreringsresultaten registreras i tabellen. 4. Koncentrationen av saltsyra bestäms enligt lagen om ekvivalenter: .
Tabell 4
Resultat av standardisering av saltsyralösning
Uppgifter
1. Formulera begreppet ekvivalent i syra-bas-reaktioner. Beräkna ekvivalenterna för soda och fosforsyra i följande reaktioner:
Na2CO3 + HCl = NaHCO3 + NaCl
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
H3PO4 + NaOH = NaH2PO4 + H2O
H3PO4 + 2NaOH = Na2HPO4 + H2O
H3PO4 + 3NaOH = Na3PO4 + 3H2O
2. Skriv reaktionsekvationerna mellan saltsyra, svavelsyra, natriumhydroxid, aluminiumhydroxid, natriumkarbonat, kaliumbikarbonat och beräkna ekvivalentmassan av dessa ämnen.
3. Rita en titreringskurva för 100,00 cm 3 saltsyra med en molär koncentration motsvarande 0,1 mol/dm 3 med natriumhydroxid med en molär koncentration motsvarande 0,1 mol/dm 3. Välj möjliga indikatorer
4. Rita en titreringskurva för 100,00 cm 3 akrylsyra (CH 2 = CHCOOH, pK a= 4,26) med molär koncentrationsekvivalent
0,1 mol/dm 3 natriumhydroxid med molär koncentration ekvivalent
0,1 mol/dm3. Hur förändras en lösnings sammansättning under titrering? Välj möjliga indikatorer och beräkna indikatorfelet för titreringen.
5. Rita en titreringskurva för hydrazin (N 2 H 4 + H 2 O, pK b= 6,03)
med en molär koncentration motsvarande 0,1 mol/dm 3 saltsyra
med en molär koncentrationsekvivalent av 0,1 mol/dm 3 . Vilka är likheterna
och skillnaden i pH-beräkningar och titreringskurva jämfört med titreringskurvan för en svag syra med alkali? Välj möjliga indikatorer
och beräkna indikatortitreringsfelet.
6. Beräkna aktivitetskoefficienter och koncentrationer av aktiva joner
i 0,001 M lösning av aluminiumsulfat, 0,05 M natriumkarbonat, 0,1 M kaliumklorid.
7. Beräkna pH för en 0,20 M metylaminlösning om dess jonisering i en vattenlösning beskrivs av ekvationen
B + H2O = BH + + OH-, K b= 4,6 × 10 - 3, där B är basen.
8. Beräkna dissociationskonstanten för underklorsyra HOCl om en 1,99 × 10 - 2 M lösning har pH = 4,5.
9. Beräkna pH för en lösning som innehåller 6,1 g/mol glykolsyra (CH 2 (OH)COOH, K A= 1,5 × 10-4).
10. Beräkna pH för lösningen som erhålls genom att blanda 40 ml 0,015 M saltsyralösning med:
a) 40 ml vatten;
b) 20 ml 0,02 M natriumhydroxidlösning;
c) 20 ml 0,02 M bariumhydroxidlösning;
d) 40 ml 0,01 M lösning av underklorsyrlighet, K A=5,0 × 10 - 8.
11. Beräkna koncentrationen av acetatjon i en lösning av ättiksyra
med en massandel av 0,1 %.
12. Beräkna koncentrationen av ammoniumjon i en ammoniaklösning med en massfraktion på 0,1 %.
13. Beräkna massan av ett prov av natriumkarbonat som krävs för att framställa 250,00 ml av en 0,5000 M lösning.
14. Beräkna volymen av en lösning av saltsyra med en molär koncentration motsvarande 11 mol/l och volymen vatten som måste tas för att framställa 500 ml av en 0,5 M lösning av saltsyra.
15. 0,15 g metalliskt magnesium löstes i 300 ml av en 0,3% lösning av saltsyra. Beräkna molkoncentrationen av väte, magnesium och klorjoner i den resulterande lösningen.
16. När 25,00 ml svavelsyralösning blandas med en bariumkloridlösning erhålls 0,2917 g bariumsulfat. Bestäm titern för svavelsyralösningen.
17. Beräkna massan av kalciumkarbonat som reagerade
med 80,5 mmol saltsyra.
18. Hur många gram mononatriumfosfat ska tillsättas?
till 25,0 ml 0,15 M natriumhydroxidlösning för att erhålla en lösning med pH = 7? För fosforsyra pK a1= 2,15; pK a2= 7,21; pK a3 = 12,36.
19. För att titrera 1 0000 g rykande svavelsyra, noggrant utspädd med vatten, förbrukas 43,70 ml 0,4982 M natriumhydroxidlösning. Rykande svavelsyra är känt för att innehålla svavelsyraanhydrid löst i vattenfri svavelsyra. Beräkna massfraktionen av svavelsyraanhydrid i rykande svavelsyra.
20. Det absoluta felet vid mätning av volym med en byrett är 0,05 ml. Beräkna det relativa felet för att mäta volymer i 1; 10 och 20 ml.
21. En lösning bereds i en mätkolv med en kapacitet på 500,00 ml
från ett prov på 2,5000 g natriumkarbonat. Beräkna:
a) molär koncentration av lösningen;
b) molär koncentration av ekvivalenten (½ Na2CO3);
c) lösningstiter;
d) titer för saltsyra.
22. Vad är volymen av 10% natriumkarbonatlösning med densiteten
1,105 g/cm 3 måste tas för beredning:
a) 1 liter lösning med en titer av TNa2CO3 = 0,005000 g/cm3;
b) 1 liter lösning med TNa2CO3/HCl = 0,003000 g/cm3?
23. Vilken volym saltsyra med en massfraktion på 38,32 % och en densitet på 1,19 g/cm3 bör tas för att framställa 1500 ml av en 0,2 M lösning?
24. Vilken volym vatten måste tillsättas till 1,2 L 0,25 M HCl för att framställa en 0,2 M lösning?
25. Från 100 g teknisk natriumhydroxid innehållande 3 % natriumkarbonat och 7 % likgiltiga föroreningar framställdes 1 liter lösning. Beräkna molkoncentrationen och saltsyratitern för den resulterande alkaliska lösningen, under antagande att natriumkarbonat titreras till kolsyra.
26. Det finns ett prov som kan innehålla NaOH, Na2CO3, NaHCO3 eller en blandning av dessa föreningar som väger 0,2800 g. Provet löstes i vatten.
För att titrera den resulterande lösningen i närvaro av fenolftalein konsumeras 5,15 ml och i närvaro av metylorange - 21,45 ml saltsyra med en molär koncentrationsekvivalent på 0,1520 mol/l. Bestäm provets sammansättning och massfraktionerna av komponenterna i provet.
27. Rita en titreringskurva för en 100,00 cm 3 0,1000 M ammoniaklösning med en 0,1000 M saltsyralösning, motivera valet av indikator.
28. Beräkna pH för ekvivalenspunkten, början och slutet av titreringen av 100,00 cm 3 0,1000 M malonsyralösning (HOOCCH 2 COOH) med 0,1000 M natriumhydroxidlösning (pK) en 1=1,38; rK en 2=5,68).
29. Titreringen av 25,00 cm 3 natriumkarbonatlösning med en molär koncentrationsekvivalent av 0,05123 mol/dm 3 krävde 32,10 cm 3 saltsyra. Beräkna den molära koncentrationen av saltsyraekvivalenten.
30. Hur många ml 0,1 M ammoniumkloridlösning måste tillsättas
till 50,00 ml 0,1 M ammoniaklösning för att bilda en buffertlösning
med pH=9,3.
31. En blandning av svavelsyra och fosforsyra överfördes till en 250,00 cm 3 mätkolv. För titrering togs två prover på 20,00 cm 3, varav ett titrerades med en lösning av natriumhydroxid med en molär koncentration av motsvarande
0,09940 mol/dm 3 med metylorange indikator och den andra med fenolftalein. Natriumhydroxidförbrukningen i det första fallet var 20,50 cm 3 och i det andra fallet 36,85 cm 3 . Bestäm massorna av svavelsyra och fosforsyra i blandningen.
I komplexometri
Upp till ekvivalenspunkten =( C M V M – C EDTA V EDTA)/( V M+ V EDTA). (21)
Vid ekvivalenspunkten = ![]() . (22)
. (22)
Efter ekvivalenspunkten =  . (23)
. (23)
I fig. Figur 9 visar titreringskurvorna för kalciumjoner i buffertlösningar med olika pH-värden. Det kan ses att titrering av Ca 2+ är möjlig endast vid pH ³ 8.
Reagenser
2. H2O destillerad.
3. Standardlösning av Mg(II) med molär koncentration
0,0250 mol/dm3.
4. Ammoniakbuffert med pH = 9,5.
5. Lösning av kaliumhydroxid KOH med en massfraktion av 5 %.
6. Eriokromsvart T, indikatorblandning.
7. Kalcon, indikatorblandning.
Metodens teoretiska grunder:
Metoden är baserad på interaktionen av Ca 2+ och Mg 2+ joner med dinatriumsaltet av etylendiamintetraättiksyra (Na 2 H 2 Y 2 eller Na-EDTA) med bildning av stabila komplex i molförhållandet M:L=1 :1 i ett visst pH-område.
För att fixera ekvivalenspunkten vid bestämning av Ca 2+ och Mg 2+ används calcon och eriochrome black T.
Bestämning av Ca 2+ utförs vid pH ≈ 12, medan Mg 2+ är
i lösning i form av en fällning av magnesiumhydroxid och titreras inte med EDTA.
Mg 2+ + 2OH - = Mg(OH) 2 ↓
Ca 2+ + Y 4- « CaY 2-
Vid pH ≈ 10 (ammoniakbuffertlösning) är Mg 2+ och Ca 2+
i lösning i form av joner och efter tillsats av EDTA titreras tillsammans.
Ca 2+ + HY 3- « CaY 2- + H+
Mg2+ + HY3- «MgY2- +H+
För att bestämma volymen EDTA som spenderas på titreringen av Mg 2+,
från den totala volymen som används för att titrera blandningen vid pH ≈ 10, subtrahera volymen som används för titrering av Ca 2+ vid pH ≈ 12.
För att skapa ett pH ≈ 12, använd en 5% KOH-lösning för att skapa
pH ≈ 10 använd en ammoniakbuffertlösning (NH 3 × H 2 O + NH 4 Cl).
Arbetsprocess:
1. Standardisering av titrant - EDTA-lösning (Na 2 H 2 Y)
En EDTA-lösning bereds med en ungefärlig koncentration av 0,025 M
från ≈ 0,05 M lösning, späd den med destillerat vatten 2 gånger. För att standardisera EDTA, använd en standardlösning av MgSO 4
med en koncentration av 0,02500 mol/dm3.
Schema 5. Standardisering av titrant - EDTA-lösning
 I en konisk titreringskolv med en kapacitet på 250 cm 3, placera 20,00 cm 3 av en standard MgSO 4-lösning med en koncentration av 0,02500 mol/dm 3, tillsätt ~ 70 cm 3 destillerat vatten, ~ 10 cm 3 ammoniakbuffertlösning med pH ~ 9,5 – 10 och tillsätt indikatorn eriochrome black T ca 0,05 g
I en konisk titreringskolv med en kapacitet på 250 cm 3, placera 20,00 cm 3 av en standard MgSO 4-lösning med en koncentration av 0,02500 mol/dm 3, tillsätt ~ 70 cm 3 destillerat vatten, ~ 10 cm 3 ammoniakbuffertlösning med pH ~ 9,5 – 10 och tillsätt indikatorn eriochrome black T ca 0,05 g
(i spetsen av spateln). I det här fallet blir lösningen vinröd. Lösningen i kolven titreras långsamt med EDTA-lösning tills färgen ändras från vinröd till grön. Titreringsresultaten registreras i tabellen. 6. Koncentrationen av EDTA bestäms enligt lagen om ekvivalenter: ![]() .
.
Tabell 6
Resultat av standardisering av EDTA-lösning
2. Bestämning av Ca 2+ innehåll
Titreringskurvor för Ca2+ med EDTA-lösning vid pH=10 och pH=12 konstrueras oberoende av varandra.
Lösningen av problemet i en mätkolv bringas till märket med destillerat vatten och blandas noggrant.
Schema 6. Bestämning av Ca 2+ innehåll i lösning
 En alikvot av testlösningen 25,00 cm 3 innehållande kalcium och magnesium placeras i en konisk titreringskolv med en kapacitet på 250 cm 3, ~ 60 cm 3 vatten, ~ 10 cm 3 av en 5% KOH-lösning tillsätts. Efter att en amorf fällning av Mg(OH) 2 ↓ har bildats tillsätts en kalkonindikator på cirka 0,05 g till lösningen (vid spetsen av en spatel) och titreras långsamt med en EDTA-lösning tills färgen ändras från rosa till ljusblått. . Titreringsresultat ( V 1) anges i tabell 7.
En alikvot av testlösningen 25,00 cm 3 innehållande kalcium och magnesium placeras i en konisk titreringskolv med en kapacitet på 250 cm 3, ~ 60 cm 3 vatten, ~ 10 cm 3 av en 5% KOH-lösning tillsätts. Efter att en amorf fällning av Mg(OH) 2 ↓ har bildats tillsätts en kalkonindikator på cirka 0,05 g till lösningen (vid spetsen av en spatel) och titreras långsamt med en EDTA-lösning tills färgen ändras från rosa till ljusblått. . Titreringsresultat ( V 1) anges i tabell 7.
Tabell 7
| Erfarenhet nr. | Volym av EDTA, cm 3 | Ca 2+ innehåll i lösning, g | |
| 25,00 | |
||
| 25,00 | |||
| 25,00 | |||
| 25,00 | |||
| 25,00 |
3. Bestämning av Mg2+-innehåll
Titreringskurvan för Mg 2+ med EDTA-lösning vid pH=10 konstrueras oberoende.
Schema 7. Bestämning av Mg 2+ innehåll i lösning

En alikvot på 25,00 cm 3 av testlösningen innehållande kalcium och magnesium placeras i en konisk titreringskolv med en kapacitet på 250 cm 3, ~ 60 cm 3 destillerat vatten, ~ 10 cm 3 ammoniakbuffertlösning med pH ~ 9,5– 10 tillsätts, och en indikator tillsätts eriokromsvart T ca 0,05 g
(i spetsen av spateln). I det här fallet blir lösningen vinröd. Lösningen i kolven titreras långsamt med EDTA-lösning tills färgen ändras från vinröd till grön. Titreringsresultat ( V 2) in i tabellen. 8.
Tabell 8
Resultat av titrering av en lösning som innehåller kalcium och magnesium
| Erfarenhet nr. | Volymen av testlösningen, cm 3 | Volym av EDTA, V∑, cm 3 | Mg 2+ innehåll i lösning, g |
| 25,00 | |||
| 25,00 | |||
| 25,00 | |||
| 25,00 | |||
| 25,00 |
Reagenser
1. EDTA-lösning med en molär koncentration av ~ 0,05 mol/dm 3.
2. Standardlösning av Cu(II) med en titer på 2,00x10-3 g/dm3.
3. H2O destillerad.
4. Ammoniakbuffert med pH ~ 8 – 8,5.
5. Murexide, indikatorblandning.
Uppgifter
1. Beräkna α 4 för EDTA vid pH=5, om joniseringskonstanterna för EDTA är som följer: K 1 =1,0·10 -2, K 2 =2,1·10 -3, K 3 =6,9·10 -7 , K 4 =5,5·10-11.
2. Rita en titreringskurva för 25,00 ml 0,020 M nickellösning med 0,010 M EDTA-lösning vid pH = 10, om stabilitetskonstanten
K NiY = 10 18,62. Beräkna p efter att ha lagt till 0,00; 10.00; 25.00; 40,00; 50,00 och 55,00 ml titrant.
3. För titrering av 50,00 ml lösning innehållande kalciumjoner
och magnesium tog det 13,70 ml 0,12 M EDTA-lösning vid pH=12 och 29,60 ml vid pH=10. Uttryck koncentrationerna av kalcium och magnesium i lösning i mg/ml.
4. Vid analys av 1 liter vatten hittades 0,2173 g kalciumoxid och 0,0927 g magnesiumoxid. Beräkna vilken volym av EDTA med en koncentration av 0,0500 mol/l som användes på titrering.
5. För att titrera 25,00 ml av en standardlösning innehållande 0,3840 g magnesiumsulfat, konsumerades 21,40 ml Trilon B-lösning. Beräkna titern för denna lösning för kalciumkarbonat och dess molära koncentration.
6. Utvärdera möjligheten för komplexometrisk titrering av metalljoner vid pH = 2, baserat på bildningskonstanterna (stabiliteten) för metallkomplexonater som anges nedan; 5; 10; 12.
7. Vid titrering av en 0,01 M lösning av Ca 2+ med en 0,01 M lösning av EDTA vid pH = 10, är stabilitetskonstanten K CaY = 10 10,6. Beräkna vad den villkorade stabilitetskonstanten för metallkomplexet med indikatorn ska vara vid pH=10 om = vid titreringens slutpunkt.
8. Syrajoniseringskonstanten för indikatorn som används vid komplexometrisk titrering är 4,8·10 -6. Beräkna halten av sura och alkaliska former av indikatorn vid pH = 4,9, om dess totala koncentration i lösningen är 8,0·10 -5 mol/l. Bestäm möjligheten att använda denna indikator vid titrering av en lösning
med pH=4,9, om färgen på dess syraform matchar färgen på komplexet.
9. För att bestämma aluminiumhalten i provet löstes ett 550 mg prov och 50,00 ml av en 0,05100 M lösning av komplexon III tillsattes. Överskottet av den senare titrerades med 14,40 ml 0,04800 M zink(II)-lösning. Beräkna massfraktionen av aluminium i provet.
10. När ett komplex som innehåller vismut och jodidjoner förstörs, titreras de senare med en lösning av Ag(I) och vismut med komplexon III.
För att titrera en lösning innehållande 550 mg prov krävs 14,50 ml 0,05000 M lösning av komplexon III, och för att titrera jodidjonen som finns i 440 mg prov krävs 23,25 ml 0,1000 M Ag(I)-lösning. Beräkna koordinationstalet för vismut i komplexet om jodidjoner är liganden.
11.
Ett prov som vägde 0,3280 g innehållande Pb, Zn, Cu löstes
och överfördes till en 500,00 cm 3 mätkolv. Bestämningen genomfördes i tre steg:
a) för titreringen av den första portionen av en lösning med en volym av 10,00 cm3 innehållande Pb, Zn, Cu, användes 37,50 cm3 av 0,0025 M EDTA-lösning; b) i den andra delen med en volym av 25,00 cm^ maskerades Cu, och 27,60 cm^ EDTA användes för titrering av Pb och Zn; c) i den tredje delen med en volym av 100,00 cm maskerades Zn
och Cu, 10,80 cm3 EDTA användes på titreringen av Pb. Bestäm massfraktionen av Pb, Zn, Cu i provet.
Titreringskurvor
I redoxmetri ritas titreringskurvor i koordinater E = f(C R),
de illustrerar grafiskt förändringen i systempotential under titreringsprocessen. Före ekvivalenspunkten beräknas systemets potential genom förhållandet mellan koncentrationerna av de oxiderade och reducerade formerna av analyten (eftersom före ekvivalenspunkten är en av titreringsformerna praktiskt taget frånvarande), efter ekvivalenspunkten - med förhållandet mellan koncentrationerna av den oxiderade och reducerade formen av titranten (eftersom analyten efter ekvivalenspunkten titreras nästan fullständigt).
Potentialen vid ekvivalenspunkten bestäms av formeln
 , (26)
, (26)
var är antalet elektroner som deltar i halvreaktioner;
– standardelektrodpotentialer för halvreaktioner.
I fig. Figur 10 visar titreringskurvan för en lösning av oxalsyra H 2 C 2 O 4 med en lösning av kaliumpermanganat KMnO 4 i ett surt medium
(= 1 mol/dm3).

Ris. 10. Titreringskurva för 100,00 cm 3 oxallösning
syror H 2 C 2 O 4 s C1/z= 0,1000 mol/dm 3 permanganatlösning
kalium KMnO 4 s C1/z= 0,1000 mol/dm 3 vid = 1 mol/dm 3
Halvreaktionspotential MnO 4 - + 5 e+ 8H + → Mn 2+ + 4H 2 O beror på mediets pH, eftersom vätejoner deltar i halvreaktionen.
Permanganatometri
Titranten är en lösning av kaliumpermanganat KMnO 4, som är ett starkt oxidationsmedel. Grundläggande ekvation:
MnO4 - +8H + + 5e = Mn2+ + 4H2O, ![]() =+1,51 V.
=+1,51 V.
M1/z (KMnO4) = ![]() g/mol.
g/mol.
I svagt sura, neutrala och lätt alkaliska miljöer, på grund av den lägre redoxpotentialen, reduceras permanganatjonen till Mn +4.
MnO 4 - +2H 2 O + 3e = MnO 2 ¯ + 4OH -, ![]() = +0,60 V.
= +0,60 V.
M1/z (KMnO4) = 158,03/3 = 52,68 g/mol.
I en alkalisk miljö reduceras en lösning av kaliumpermanganat
upp till Mn +6.
MnO 4 - + 1e = MnO 4 2-, ![]() = +0,558 V.
= +0,558 V.
M1/z (KMnO4) = 158,03 g/mol.
För att eliminera sidoreaktioner utförs titrering med kaliumpermanganat i en sur miljö, som skapas med svavelsyra. Det rekommenderas inte att använda saltsyra för att skapa ett medium, eftersom kaliumpermanganat kan oxidera kloridjonen.
2Cl - – 2e = Cl2, = +1,359 V.
Kaliumpermanganat används oftast i form av en lösning.
med en molekvivalentkoncentration på ~ 0,05 – 0,1 mol/dm 3 . Det är inte en primär standard på grund av det faktum att vattenlösningar av kaliumpermanganat kan oxidera vatten och organiska föroreningar i det:
4MnO4- + 2H2O = 4MnO2 ¯+ 3O2 + 4OH -
Nedbrytningen av kaliumpermanganatlösningar påskyndas i närvaro av mangandioxid. Eftersom mangandioxid är en produkt av nedbrytningen av permanganat har denna fällning autokatalytisk effekt till nedbrytningsprocessen.
Fast kaliumpermanganat som används för att framställa lösningar är förorenat med mangandioxid, så det är omöjligt att förbereda en lösning från ett exakt prov. För att få en tillräckligt stabil lösning av kaliumpermanganat, efter upplösning av ett prov av KMnO 4 i vatten, lämnas det i en mörk flaska i flera dagar (eller kokas), och sedan separeras MnO 2 genom filtrering genom glas filter (ett pappersfilter kan inte användas, eftersom det reagerar med kaliumpermanganat och bildar mangandioxid).
Färgen på kaliumpermanganatlösningen är så intensiv att
att en indikator inte krävs i denna metod. För att ge en märkbar rosa färg till 100 cm 3 vatten räcker det med 0,02 - 0,05 cm 3 KMnO 4 -lösning
med en molär koncentrationsekvivalent av 0,1 mol/dm3 (0,02 M). Färgen på kaliumpermanganat vid slutpunkten av titreringen är instabil och missfärgas gradvis som ett resultat av interaktionen av överskott av permanganat
med mangan(II)joner närvarande vid slutpunkten i relativt stora mängder:
2MnO4 - + 3Mn2+ + 2H2O «5MnО2 ¯ + 4H +
Standardisering av fungerande lösning KMnO4 utförs med natriumoxalat eller oxalsyra (nyligen omkristalliserad och torkad vid 105°C).
Använd lösningar av primär standard med en molär koncentrationsekvivalent MED(½ Na2C2O4) = 0,1000 eller 0,05000 mol/l.
C 2 O 4 2- – 2e ® 2CO 2 , = -0,49 V