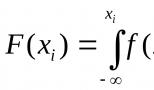রসায়নে থার্মোডাইনামিক ভারসাম্য কী? থার্মোডাইনামিক ভারসাম্য এবং স্থিতিশীলতা। পর্যায় পরিবর্তন. অন্যান্য অভিধানে "থার্মোডাইনামিক ভারসাম্য" কী তা দেখুন
আইসোবারিক-আইসোথার্মাল অবস্থার অধীনে একটি প্রক্রিয়ার ভারসাম্যের জন্য থার্মোডাইনামিক অবস্থা হল গিবস শক্তির পরিবর্তন (D আর জি(টি)=0)। যখন প্রতিক্রিয়া ঘটে n ক A+n খ B=n সঙ্গে C+n dস্ট্যান্ডার্ড গিবস শক্তির পরিবর্তন হল:
ডি আর জি 0 টি=(n গ×D চ জি 0 সি+ n d×D চ জি 0 ডি)-(n ক×D চ জি 0 A+ n খ×D চ জি 0 খ).
এই অভিব্যক্তিটি একটি আদর্শ প্রক্রিয়ার সাথে মিলে যায় যেখানে বিক্রিয়কগুলির ঘনত্ব একতার সমান এবং বিক্রিয়ার সময় অপরিবর্তিত থাকে। বাস্তব প্রক্রিয়া চলাকালীন, বিকারকগুলির ঘনত্ব পরিবর্তিত হয়: প্রাথমিক পদার্থের ঘনত্ব হ্রাস পায় এবং প্রতিক্রিয়া পণ্যগুলির ঘনত্ব বৃদ্ধি পায়। গিবস শক্তির ঘনত্ব নির্ভরতা বিবেচনায় নিয়ে (রাসায়নিক সম্ভাবনা দেখুন), প্রতিক্রিয়ার সময় এর পরিবর্তন সমান:
ডি r G T=–
– =
= (n গ×D চ জি 0 গ+n d×D চ জি 0 ডি) – (n ক×D চ জি 0 ক+n খ×D চ জি 0 খ) +
+ R×T×(n গ×ln গ গ+n d×ln সি ডি-n ক×ln গ এ-n খ×ln গ খ)
ডি r G T= ডি আর জি 0 টি + R×T× ,
কোথায় ![]() - মাত্রাহীন ঘনত্ব i-ম পদার্থ;
- মাত্রাহীন ঘনত্ব i-ম পদার্থ;
একাদশ- আঁচিল ভগ্নাংশ i-ম পদার্থ;
p i- আংশিক চাপ i-ম পদার্থ; আর 0 = 1.013×10 5 Pa – আদর্শ চাপ;
i এর সাথে- মোলার ঘনত্ব i-ম পদার্থ; সঙ্গে 0 =1 mol/l - মান ঘনত্ব।
ভারসাম্যপূর্ণ অবস্থায়
ডি আর জি 0 T+R×T×  = 0,
= 0,
 .
.
মাত্রা প্রতি 0 বলা হয় বিক্রিয়ার স্ট্যান্ডার্ড (থার্মোডাইনামিক) ভারসাম্য ধ্রুবক।অর্থাৎ একটি নির্দিষ্ট তাপমাত্রায় টিসিস্টেমে সংঘটিত ফরোয়ার্ড এবং রিভার্স প্রতিক্রিয়ার ফলে, বিক্রিয়কগুলির নির্দিষ্ট ঘনত্বে ভারসাম্য প্রতিষ্ঠিত হয় - ভারসাম্য ঘনত্ব (সঙ্গে i) আর . ভারসাম্য ঘনত্বের মানগুলি ভারসাম্য ধ্রুবকের মান দ্বারা নির্ধারিত হয়, যা তাপমাত্রার একটি ফাংশন এবং এনথালপির উপর নির্ভর করে (D r N 0) এবং এনট্রপি (D আর এস 0) প্রতিক্রিয়া:
ডি আর জি 0 T+R× টি×ln কে 0 = 0,
![]() , ,
, ,
যেহেতু ডি আর জি 0 টি=D r N 0 টি - টি×D আর এস 0 টি,
![]() .
.
যদি এনথালপি মান (ডি r N 0 টি) এবং এনট্রপি (ডি আর এস 0 টি) বা ডি আর জি 0 টিপ্রতিক্রিয়া, তারপর আদর্শ ভারসাম্য ধ্রুবকের মান গণনা করা যেতে পারে।
প্রতিক্রিয়া ভারসাম্য ধ্রুবক আদর্শ গ্যাস মিশ্রণ এবং সমাধান বৈশিষ্ট্য. বাস্তব গ্যাস এবং সমাধানগুলির মধ্যে আন্তঃআণবিক মিথস্ক্রিয়া প্রকৃতগুলি থেকে গণনাকৃত ভারসাম্যের ধ্রুবকগুলির বিচ্যুতি ঘটায়। এটি বিবেচনায় নেওয়ার জন্য, গ্যাস মিশ্রণের উপাদানগুলির আংশিক চাপের পরিবর্তে, তাদের অস্পষ্টতা ব্যবহার করা হয় এবং সমাধানগুলিতে পদার্থের ঘনত্বের পরিবর্তে তাদের কার্যকলাপ (রাসায়নিক সম্ভাবনা দেখুন)।
ভারসাম্য পরিবর্তন.
একটি বদ্ধ ব্যবস্থায় ভারসাম্যের সময়ে, বিক্রিয়কগুলির ভারসাম্য ঘনত্ব প্রতিষ্ঠিত হয়। যদি একটি সিস্টেমে থার্মোডাইনামিক ভারসাম্যের প্যারামিটারগুলির একটি পরিবর্তন হয় (তাপমাত্রা, চাপ, মিথস্ক্রিয়াকারী পদার্থের পরিমাণ), তবে সিস্টেমটি ভারসাম্যের অন্য অবস্থায় চলে যায়। যদি, রূপান্তরের ফলস্বরূপ, প্রতিক্রিয়া পণ্যগুলির ভারসাম্য ঘনত্ব বৃদ্ধি পায়, তবে আমরা সামনের দিকে (ডান দিকে) একটি ভারসাম্য স্থানান্তরের কথা বলি, যদি প্রারম্ভিক পদার্থের ভারসাম্য ঘনত্ব বৃদ্ধি পায়, তবে এটি একটি ভারসাম্য। বিপরীত দিকে (বাম দিকে) স্থানান্তর করুন।
আইসোবার এবং বিক্রিয়া আইসোথার্ম সমীকরণ ব্যবহার করে "ভারসাম্য পরিবর্তনের দিক" নির্ধারণ করা যেতে পারে।
আইসোবার প্রতিক্রিয়া
ডেরিভেটিভ ln কেধ্রুবক চাপে তাপমাত্রা 0 এর সমান:
![]() .
.
এই সমীকরণ বলা হয় আইসোবারিক প্রতিক্রিয়া।অনুশীলনে, আনুমানিক গণনার জন্য আমরা ধরে নিতে পারি যে D r N 0 টি» ডি r N 0 298, তারপর
![]() .
.
যদি প্রতিক্রিয়ার তাপীয় প্রভাবের চিহ্নটি জানা যায়, তবে প্রতিক্রিয়া মিশ্রণের তাপমাত্রা পরিবর্তিত হলে "ভারসাম্য পরিবর্তনের দিক" নির্ধারণ করা সম্ভব।
আইসোবার সমীকরণের বিশ্লেষণ.
একটি প্রতিক্রিয়া সিস্টেমে সঞ্চালিত যাক
n ক A+n খ B↔n সঙ্গে C+n dডি.
![]() ,
,  .
.
যেহেতু তাপমাত্রা এবং সার্বজনীন গ্যাস ধ্রুবক ধনাত্মক, তাই ফাংশনের ডেরিভেটিভের চিহ্ন ln কে 0 (টি) বিক্রিয়ার তাপীয় প্রভাবের চিহ্ন দ্বারা নির্ধারিত হয়।
1. এক্সোথার্মিক বিক্রিয়া – D r N 0 <0. Поскольку производная , то функция কে(টি) হ্রাস, অর্থাৎ, তাপমাত্রা বৃদ্ধির সাথে, ভারসাম্য ধ্রুবক হ্রাস পায়। ফলস্বরূপ, তাপমাত্রা বৃদ্ধির সাথে সাথে, ভারসাম্য বিপরীত দিকে সরে যায় (ভারসাম্যের ধ্রুবক হ্রাসের জন্য লব হ্রাসের প্রয়োজন হয় এবং সেই অনুযায়ী, হর বৃদ্ধি পায়)।
2. এন্ডোথার্মিক বিক্রিয়া – D r N 0 >0। ডেরিভেটিভ তাই একটি ফাংশন কে(টি) ক্রমবর্ধমান, অর্থাৎ, ক্রমবর্ধমান তাপমাত্রার সাথে, ভারসাম্য ক্রমাগত বৃদ্ধি পায়। এই ক্ষেত্রে, ভারসাম্য সামনের দিকে স্থানান্তরিত হয় (ভারসাম্যের ধ্রুবক বৃদ্ধির জন্য লব বৃদ্ধি এবং হর হ্রাস করা প্রয়োজন)।
প্রতিক্রিয়া ইসোথার্ম
প্রতিক্রিয়া n সিস্টেমে সঞ্চালিত যাক ক A+n খখ ↔ n সঙ্গে C+n d D. যদি সিস্টেমটি ভারসাম্য না থাকে (D r G T¹0), তারপর বিক্রিয়াকারী পদার্থের ঘনত্ব ভারসাম্যের থেকে আলাদা। এই ক্ষেত্রে, প্রতিক্রিয়ার গিবস শক্তির পরিবর্তন সমান:
ডি r G T=D আর জি 0 T+R× টি×¹0, ডি r G T=D আর জি 0 T+R× টি ln K T ×¹0,
কোথায় ![]() - ভারসাম্যের ধ্রুবকের ধরন অনুসারে নির্মিত একটি অভিব্যক্তি, যা ভারসাম্যের অবস্থায় নেই এমন একটি সিস্টেমে প্রতিক্রিয়াশীল পদার্থের ঘনত্ব ধারণ করে। প্রাথমিক সময়ে এই ঘনত্বগুলি নির্বিচারে এবং প্রতিক্রিয়ার সময় ভারসাম্যের মানগুলিতে পরিবর্তিত হয়।
- ভারসাম্যের ধ্রুবকের ধরন অনুসারে নির্মিত একটি অভিব্যক্তি, যা ভারসাম্যের অবস্থায় নেই এমন একটি সিস্টেমে প্রতিক্রিয়াশীল পদার্থের ঘনত্ব ধারণ করে। প্রাথমিক সময়ে এই ঘনত্বগুলি নির্বিচারে এবং প্রতিক্রিয়ার সময় ভারসাম্যের মানগুলিতে পরিবর্তিত হয়।
যেহেতু ডি আর জি 0 T+R× টি×ln কে 0 =0 ® D আর জি 0 টি= –আর× টি×ln কে 0 ,
কোথায়  তাহলে ভারসাম্য ধ্রুবক
তাহলে ভারসাম্য ধ্রুবক
ডি r G T = আর× টি(ln ক ট-এলএন কে 0).
এই সমীকরণ বলা হয় প্রতিক্রিয়া isotherm. এর সাহায্যে, আপনি বিকারকগুলির ঘনত্বের অনুপাতের উপর নির্ভর করে একটি ধ্রুবক তাপমাত্রায় রাসায়নিক বিক্রিয়ার দিক নির্ধারণ করতে পারেন।
আইসোথার্ম সমীকরণের বিশ্লেষণ.
1. যদি প্রারম্ভিক পদার্থ (A, B) এবং পণ্যগুলির (C, D) ঘনত্বের অনুপাত এমন হয় যে ক ট=কে 0 তারপর D r G T=আর× টি(ln ক ট - ln কে 0)=0. সিস্টেমটি ভারসাম্যপূর্ণ অবস্থায় রয়েছে।
2. A, B, C এবং D বিকারকগুলির প্রাথমিক ঘনত্বের অনুপাত যদি এমন হয় যে ক ট<কে 0, অর্থাৎ প্রারম্ভিক পদার্থের ঘনত্ব কএবং খভারসাম্য মানের চেয়ে বেশি, এবং C এবং D পণ্যের ঘনত্ব কম, তারপর D r G T=আর× টি(ln ক ট-এলএন কে 0) <0. Реакция самопроизвольно протекает в прямом направлении. При этом концентрации исходных веществ уменьшаются, а продуктов увеличиваются. Соответственно увеличивается величина ক ট. যখন এটি মান পৌঁছায় কে 0 সিস্টেমটি ভারসাম্যের অবস্থায় পৌঁছেছে (D r G T=0).
3. A, B, C এবং D বিকারকগুলির প্রাথমিক ঘনত্বের অনুপাত যদি এমন হয় যে ক ট > কে 0, তাহলে গিবস শক্তির পরিবর্তন শূন্যের চেয়ে বেশি। প্রতিক্রিয়া স্বতঃস্ফূর্তভাবে বিপরীত দিকে অগ্রসর হয় যতক্ষণ না সিস্টেমটি ভারসাম্যে পৌঁছায়। এই ক্ষেত্রে, পণ্যগুলির ঘনত্ব হ্রাস পায় এবং প্রারম্ভিক পদার্থগুলি ভারসাম্যের মানগুলিতে বৃদ্ধি পায়।
একটি প্রতিক্রিয়ার আইসোথার্ম এবং আইসোবার সমীকরণ বিশ্লেষণ করে তৈরি করা রাসায়নিক ভারসাম্যের পরিবর্তনের উপর তাপমাত্রা, চাপ এবং বিকারকগুলির ঘনত্বের পরিবর্তনের প্রভাব সম্পর্কে সিদ্ধান্তগুলি সম্পূর্ণরূপে লে চ্যাটেলিয়ারের অভিজ্ঞতামূলক নিয়ম অনুসারে ( লে চ্যাটেলিয়ার). যদি ভারসাম্যের অবস্থায় একটি সিস্টেমে বাহ্যিক প্রভাব প্রয়োগ করা হয়, তাহলে ভারসাম্য এমন একটি প্রক্রিয়ার দিকে চলে যায় যা বাহ্যিক প্রভাবের প্রভাবকে দুর্বল করে দেয়।এই নিয়মটি আপনাকে ভারসাম্য পরিবর্তনের দিক নির্ধারণ করতে দেয়।
ভারসাম্য এবং অসঙ্গতি প্রক্রিয়া. প্রত্যাবর্তনযোগ্য এবং অপরিবর্তনীয় প্রক্রিয়া।
একটি সিস্টেম হল স্থানের একটি সীমিত অঞ্চল যেখানে অধ্যয়নের ভৌত বস্তু রয়েছে। একটি সিস্টেমের সীমানা বস্তুগত বা কাল্পনিক, স্থির বা চলমান, ভেদযোগ্য বা পদার্থের অভেদ্য হতে পারে।
আমরা বৈশিষ্ট্য অধ্যয়ন করা হবে ম্যাক্রোস্কোপিক সিস্টেম,সেগুলো. বিপুল সংখ্যক কণা নিয়ে গঠিত সিস্টেম - অণু, পরমাণু বা আয়ন। এই ধরনের একটি ম্যাক্রোস্কোপিক সিস্টেম একটি পৃথক শরীর হতে পারে (উদাহরণস্বরূপ, গ্যাস, তরল এবং এর সাথে ভারসাম্যপূর্ণ বাষ্প)। সমস্ত সংস্থা যা বিবেচনাধীন সিস্টেমে অন্তর্ভুক্ত নয়, তবে এর বৈশিষ্ট্যগুলিকে প্রভাবিত করতে পারে বলা হয় পরিবেশ. যদি, উদাহরণস্বরূপ, সিস্টেমটি একটি পিস্টন সহ একটি সিলিন্ডারে আবদ্ধ একটি গ্যাস হয়, তবে সিলিন্ডার এবং পিস্টনটি সিস্টেমে অন্তর্ভুক্ত নয়, তবে সিস্টেমের বৈশিষ্ট্যগুলি, বিশেষত এর আয়তন, পিস্টনের অবস্থানের উপর নির্ভর করে। অতএব, এই ক্ষেত্রে, সিলিন্ডার এবং পিস্টন মাঝারি অন্তর্গত।
ম্যাক্রোস্কোপিক সিস্টেমের আচরণ এবং বৈশিষ্ট্যগুলি বর্ণনা করার জন্য, তারা সাধারণত সরাসরি পরিমাপযোগ্য পরিমাণ ব্যবহার করে যা সম্পূর্ণরূপে সিস্টেমটিকে এবং পরিবেশের সাথে এর সম্পর্ককে চিহ্নিত করে, কিন্তু পৃথক কণাগুলিতে প্রয়োগ করার সময় তা বোঝা যায় না। এই পরিমাণের মধ্যে, বলা হয় সিস্টেম স্টেটের ম্যাক্রোস্কোপিক প্যারামিটার, অন্তর্ভুক্ত, উদাহরণস্বরূপ, পরিমাণ যেমন P, T, V, , ইত্যাদি। সিস্টেমের অবস্থা, ম্যাক্রোপ্যারামিটার ব্যবহার করে নির্দিষ্ট করা হয় যা সামগ্রিকভাবে সিস্টেমের আচরণকে চিহ্নিত করে, বলা হয় ম্যাক্রোস্টেট.
অভিজ্ঞতা দেখায় যে কোনও ম্যাক্রোস্কোপিক সিস্টেম, বাহ্যিক পরিবেশ থেকে বিচ্ছিন্ন, সর্বদা স্বতঃস্ফূর্তভাবে তথাকথিত অবস্থায় চলে যায়। থার্মোডাইনামিক ভারসাম্য, যা এই সত্য দ্বারা চিহ্নিত করা হয় যে সিস্টেমের সমস্ত ম্যাক্রোস্কোপিক পরিবর্তন বন্ধ হয়ে যায় এবং সিস্টেমের এক বা অন্য ম্যাক্রোস্কোপিক বৈশিষ্ট্যের বৈশিষ্ট্যযুক্ত প্রতিটি প্যারামিটার সময়ের সাথে সাথে একটি ধ্রুবক মান থাকে। একটি সিস্টেম যেটি থার্মোডাইনামিক ভারসাম্যের অবস্থায় প্রবেশ করেছে তা কখনই স্বতঃস্ফূর্তভাবে প্রস্থান করতে পারে না। ভারসাম্য ব্যাহত করার জন্য বাহ্যিক প্রভাব প্রয়োজন। একটি সিস্টেমকে থার্মোডাইনামিক ভারসাম্যের অবস্থায় রূপান্তরের প্রক্রিয়া বলা হয় শিথিলকরণ, এবং এর জন্য প্রয়োজনীয় সময় বলা হয় বিনোদন সময়. বিভিন্ন সিস্টেমে বিভিন্ন প্রক্রিয়ার জন্য, শিথিলকরণের সময় আলাদা। এটি খুব ছোট এবং খুব বড় হতে পারে। উদাহরণস্বরূপ, একটি গ্যাসে চাপের সমতা এক সেকেন্ডের ভগ্নাংশে ঘটে, এবং প্রসারণের সময় ঘনত্বের সমতা গ্যাসগুলিতে কয়েক মিনিট স্থায়ী হতে পারে এবং কঠিন পদার্থে - ঘন্টা, সপ্তাহ এবং এমনকি বছর।
থার্মোডাইনামিক ভারসাম্য হল পরিসংখ্যানগত ভারসাম্য। আমরা এটি সম্পর্কে কেবল তখনই কথা বলতে পারি যখন সিস্টেমে কণার সংখ্যা খুব বেশি হয়। ভারসাম্যের একটি সিস্টেমের রাষ্ট্রীয় পরামিতিগুলি, কঠোরভাবে বলতে গেলে, স্থির থাকে না, তবে তাদের ভারসাম্যের মানগুলির চারপাশে সামান্য ওঠানামা অনুভব করে। উদাহরণস্বরূপ, বিপুল সংখ্যক অণুর সাথে, সমস্ত ভলিউম জুড়ে তাদের অভিন্ন বিতরণ থেকে কিছু বিচ্যুতি জাহাজের পৃথক অংশে ঘটতে পারে। যাইহোক, সমগ্র আয়তন জুড়ে গড় গ্যাসের ঘনত্ব একই এবং ধ্রুবক হবে।
থার্মোডাইনামিক ভারসাম্যের অবস্থা একটি ম্যাক্রোস্কোপিক সিস্টেমের সহজতম অবস্থা। এই অবস্থায়, সিস্টেমের আচরণ অল্প সংখ্যক ম্যাক্রোস্কোপিক পরামিতি দ্বারা বর্ণিত হয়। উদাহরণস্বরূপ, বাহ্যিক বল ক্ষেত্রগুলির অনুপস্থিতিতে সহজতম সিস্টেমগুলির অবস্থা - গ্যাস, তরল এবং কঠিন পদার্থগুলি, তাপগতিগত ভারসাম্যের শর্তে, P, T, V তিনটি পরিমাণের যে কোনও দুটি দ্বারা দ্ব্যর্থহীনভাবে নির্ধারিত হতে পারে, যা, বাহ্যিক ক্ষেত্রগুলির অনুপস্থিতি, সিস্টেমের সমস্ত অংশে একই মান রয়েছে। এই ধরনের প্রতিটি ভারসাম্য অবস্থা P-V বা T-V গ্রাফের একটি বিন্দু দ্বারা প্রতিনিধিত্ব করা যেতে পারে। একটি ভারসাম্যহীন অবস্থাকে এভাবে চিত্রিত করা যায় না, কারণ একটি ভারসাম্যহীন অবস্থায় অন্তত একটি প্যারামিটারের একটি নির্দিষ্ট মান থাকবে না।
যে কোন প্রক্রিয়া, যেমন একটি সিস্টেমের এক অবস্থা থেকে অন্য রাজ্যে রূপান্তর সিস্টেমের একটি ভারসাম্যহীনতার সাথে যুক্ত।এই ক্ষেত্রে, প্রক্রিয়াটি যত দ্রুত হবে ভারসাম্যহীনতা তত বেশি তাৎপর্যপূর্ণ। উদাহরণ: শক্তভাবে লাগানো পিস্টন সহ একটি সিলিন্ডারে গ্যাসের দ্রুত এবং ধীর সংকোচনের সময় P-তে পরিবর্তন।
সীমার মধ্যে, যদি গ্যাস সংকোচন অসীমভাবে ধীরে ধীরে ঘটে, তবে প্রতিটি মুহূর্তে গ্যাস নির্দিষ্ট চাপ মান দ্বারা চিহ্নিত করা হবে। ফলস্বরূপ, এই ক্ষেত্রে, সময়ের প্রতিটি মুহূর্তে গ্যাসের অবস্থা ভারসাম্যপূর্ণ, এবং একটি অসীম ধীর প্রক্রিয়া ভারসাম্য অবস্থার একটি ক্রম নিয়ে গঠিত হবে। ভারসাম্য অবস্থার একটি অবিচ্ছিন্ন ক্রম নিয়ে গঠিত একটি প্রক্রিয়াকে ভারসাম্য বা আধা-স্থির প্রক্রিয়া বলে। উপরোক্ত থেকে এটি অনুসরণ করে যে শুধুমাত্র একটি যথেষ্ট ধীর প্রক্রিয়া ভারসাম্য হতে পারে, তাই ভারসাম্য প্রক্রিয়াটি একটি বিমূর্ততা যা কার্যত ভারসাম্যের কাছাকাছি সেই প্রক্রিয়াগুলি যেখানে সিস্টেমের পরামিতিগুলির পরিবর্তনের হার পরিবর্তনের হারের চেয়ে অনেক কম। শিথিলকরণের সময় একই পরামিতিগুলির। ভারসাম্য প্রক্রিয়া একটি P-V গ্রাফ বা একটি T-V সংশ্লিষ্ট বক্ররেখাতে চিত্রিত করা যেতে পারে। একটি ভারসাম্যহীন প্রক্রিয়া গ্রাফিকভাবে চিত্রিত করা যায় না। যদি, তবুও, ভারসাম্যহীন প্রক্রিয়াগুলির জন্য একটি গ্রাফিকাল উপস্থাপনা ব্যবহার করা হয়, তবে এর কেবলমাত্র অর্থ রয়েছে যে এটি ভারসাম্যের সাথে তুলনা করে এই প্রক্রিয়াগুলির আপেক্ষিক গতিপথ দেখায়।
তাপগতিবিদ্যার সমস্ত পরিমাণগত সিদ্ধান্ত শুধুমাত্র ভারসাম্য প্রক্রিয়ার জন্য কঠোরভাবে প্রযোজ্য।
ভারসাম্য প্রক্রিয়াগুলি, অসাম্য প্রক্রিয়াগুলির বিপরীতে, একটি গুরুত্বপূর্ণ বৈশিষ্ট্য রয়েছে: এগুলি বিপরীতমুখী প্রক্রিয়া, অন্যদিকে অ-ভারসাম্য প্রক্রিয়াগুলি সর্বদা অপরিবর্তনীয়।
বিপরীত প্রক্রিয়াএকটি প্রক্রিয়া যা বিপরীত দিকে বাহিত হতে পারে যাতে সিস্টেমটি সামনের দিকের মতো একই মধ্যবর্তী অবস্থার মধ্য দিয়ে যায়, তবে বিপরীত ক্রমে, এবং যাতে সিস্টেমের চারপাশের পরিবেশে কোনও পরিবর্তন না ঘটে।
যদি প্রক্রিয়াটি এমনভাবে এগিয়ে যায় যে তার সমাপ্তির পরে সিস্টেমটিকে তার প্রাথমিক অবস্থায় ফিরিয়ে আনা যায় না যাতে এটি একই মধ্যবর্তী অবস্থার মধ্য দিয়ে যায়, তবে শুধুমাত্র বিপরীত ক্রমে, এবং যাতে পরিবেশের কোথাও কোনো পরিবর্তন না থাকে, তাহলে প্রক্রিয়াটিকে অপরিবর্তনীয় বলা হয়.
অপরিবর্তনীয় প্রক্রিয়ার বিপরীতে একটি বিপরীত প্রক্রিয়ার নিম্নলিখিত বৈশিষ্ট্য রয়েছে: যদি প্রক্রিয়াটির কিছু প্রাথমিক বিভাগে একটি ফরোয়ার্ড স্ট্রোকের সময় সিস্টেমটি তাপ Q গ্রহণ করে এবং dA কাজ করে, তবে একই বিভাগে একটি বিপরীত স্ট্রোকের সময় সিস্টেমটি তাপ দেয় Q = -Q এবং এর উপর কাজ করা হয় workdA= -dA। বিপরীত এবং অপরিবর্তনীয় প্রক্রিয়ার উদাহরণ দাও।
) পরিবেশ থেকে বিচ্ছিন্ন অবস্থায়। সাধারণভাবে, এই মানগুলি ধ্রুবক নয়, তারা শুধুমাত্র তাদের গড় মানগুলির চারপাশে ওঠানামা করে (দোদুল্যমান)। যদি একটি ভারসাম্য ব্যবস্থা বেশ কয়েকটি অবস্থার সাথে মিলে যায়, যার প্রতিটিতে সিস্টেমটি অনির্দিষ্টকালের জন্য থাকতে পারে, তবে সিস্টেমটিকে মেটাস্টেবল ভারসাম্যে বলে বলা হয়। ভারসাম্যের অবস্থায়, সিস্টেমে পদার্থ বা শক্তির কোন প্রবাহ নেই, ভারসাম্যহীন সম্ভাবনা (বা চালিকা শক্তি), বা উপস্থিত পর্যায়গুলির সংখ্যার পরিবর্তন নেই। তাপীয়, যান্ত্রিক, বিকিরণ (উজ্জ্বল) এবং রাসায়নিক ভারসাম্যের মধ্যে পার্থক্য কর। বাস্তবে, বিচ্ছিন্ন অবস্থার মানে হল যে ভারসাম্য প্রতিষ্ঠার প্রক্রিয়াগুলি সিস্টেমের সীমানায় ঘটে যাওয়া পরিবর্তনগুলির তুলনায় অনেক দ্রুত এগিয়ে যায় (অর্থাৎ, সিস্টেমের বাইরের অবস্থার পরিবর্তন), এবং সিস্টেম তার পরিবেশের সাথে পদার্থ এবং শক্তি বিনিময় করে। অন্য কথায়, থার্মোডাইনামিক ভারসাম্য অর্জিত হয় যদি শিথিলকরণ প্রক্রিয়াগুলির হার যথেষ্ট বেশি হয় (একটি নিয়ম হিসাবে, এটি উচ্চ-তাপমাত্রার প্রক্রিয়াগুলির জন্য সাধারণ) বা ভারসাম্য অর্জনের সময় দীর্ঘ হয় (এই ক্ষেত্রে ভূতাত্ত্বিক প্রক্রিয়াগুলিতে ঘটে)।
বাস্তব প্রক্রিয়ায়, অসম্পূর্ণ ভারসাম্য প্রায়শই উপলব্ধি করা হয়, তবে এই অসম্পূর্ণতার মাত্রা তাৎপর্যপূর্ণ বা নগণ্য হতে পারে। এই ক্ষেত্রে, তিনটি বিকল্প সম্ভব:
- ভারসাম্য একটি অপেক্ষাকৃত বড় সিস্টেমের যেকোনো অংশে (বা অংশে) অর্জন করা হয় - স্থানীয় ভারসাম্য,
- সিস্টেমে সংঘটিত শিথিলকরণ প্রক্রিয়াগুলির হারের পার্থক্যের কারণে অসম্পূর্ণ ভারসাম্য অর্জন করা হয় - আংশিক ভারসাম্য,
- স্থানীয় এবং আংশিক ভারসাম্য উভয়ই সঞ্চালিত হয়।
ভারসাম্যহীন ব্যবস্থায়, পদার্থ বা শক্তির প্রবাহে বা, উদাহরণস্বরূপ, পর্যায়ক্রমে পরিবর্তন ঘটে।
থার্মোডাইনামিক ভারসাম্যের স্থায়িত্ব
থার্মোডাইনামিক ভারসাম্যের একটি অবস্থাকে স্থিতিশীল বলা হয় যদি এই অবস্থায় সিস্টেমের ম্যাক্রোস্কোপিক পরামিতিগুলির কোনও পরিবর্তন না হয়।
বিভিন্ন সিস্টেমের থার্মোডাইনামিক স্থিতিশীলতার জন্য মানদণ্ড:
- বিচ্ছিন্ন (একেবারে পরিবেশের সাথে মিথস্ক্রিয়া নয়) সিস্টেম- সর্বোচ্চ এনট্রপি।
- বন্ধ সিস্টেম (কেবল তাপ তাপস্থাপক সঙ্গে বিনিময় করা হয়)- ন্যূনতম বিনামূল্যে শক্তি।
- নির্দিষ্ট তাপমাত্রা এবং চাপ সিস্টেম- ন্যূনতম গিবস সম্ভাবনা।
- স্থির এনট্রপি এবং ভলিউম সহ সিস্টেম- ন্যূনতম অভ্যন্তরীণ শক্তি।
- স্থির এনট্রপি এবং চাপ সহ সিস্টেম- ন্যূনতম এনথালপি।
আরো দেখুন
উইকিমিডিয়া ফাউন্ডেশন। 2010।
অন্যান্য অভিধানে "থার্মোডাইনামিক ভারসাম্য" কী তা দেখুন:
- (থার্মোডাইনামিক ইকুইলিব্রিয়াম দেখুন)। শারীরিক বিশ্বকোষীয় অভিধান। এম.: সোভিয়েত এনসাইক্লোপিডিয়া। এডিটর-ইন-চিফ এ.এম. প্রখোরভ। 1983. থার্মোডাইনামিক ইকুইলিব্রিয়াম... শারীরিক বিশ্বকোষ
থার্মোডাইনামিক ভারসাম্য দেখুন... বড় বিশ্বকোষীয় অভিধান
থার্মোডাইনামিক ইকুইলিব্রিয়াম - (2) … বিগ পলিটেকনিক এনসাইক্লোপিডিয়া
থার্মোডাইনামিক ভারসাম্য- থার্মোডাইনামিক ভারসাম্যের অবস্থা: সুপারহিটেড তরল এবং সুপার কুলড বাষ্পের অনুপস্থিতি। [এএস গোল্ডবার্গ। ইংরেজি-রাশিয়ান শক্তি অভিধান। 2006] বিষয় শক্তি সাধারণভাবে প্রতিশব্দ থার্মোডাইনামিক ভারসাম্যের অবস্থা EN তাপ... ... প্রযুক্তিগত অনুবাদকের গাইড
থার্মোডাইনামিক ভারসাম্য দেখুন। * * * থার্মোডাইনামিক ইকুইলিব্রিয়াম থার্মোডাইনামিক ইকুইলিব্রিয়াম, থার্মোডাইনামিক ইকুইলিব্রিয়াম দেখুন (থার্মোডাইনামিক ইকুইলিব্রিয়াম দেখুন) ... বিশ্বকোষীয় অভিধান
থার্মোডাইনামিক ইকুইলিব্রিয়াম- একটি সিস্টেমের অবস্থা যেখানে এর ম্যাক্রোস্কোপিক পরামিতি সময়ের সাথে পরিবর্তিত হয় না। সিস্টেমের এই অবস্থায়, শক্তি অপচয়ের সাথে কোন প্রক্রিয়া নেই, উদাহরণস্বরূপ, তাপ প্রবাহ বা রাসায়নিক বিক্রিয়া। আণুবীক্ষণিক বিন্দু থেকে...... Palaeomagnetology, petromagnetology এবং geology. অভিধান-রেফারেন্স বই।
থার্মোডাইনামিক ভারসাম্য- termodinaminė pusiausvyra statusas T sritis chemija apibrėžtis Nekintanti termodinaminės systemos būsena, kurioje nevyksta medžiagos arba energijos pernaša. atitikmenys: engl. থার্মোডাইনামিক ভারসাম্য থার্মোডাইনামিক ভারসাম্য... Chemijos terminų aiškinamasis žodynas
থার্মোডাইনামিক ভারসাম্য- termodinaminė pusiausvyra statusas T sritis fizika atitikmenys: engl. থার্মোডাইনামিক ভারসাম্য vok. তাপমাত্রা থার্মোডাইনামিক ভারসাম্য, n pranc. সামঞ্জস্যপূর্ণ থার্মোডাইনামিক, m … ফিজিকোস টার্মিনোজ যোডিনাস
1. স্থিতিশীল ভারসাম্য।
2. অস্থির (অস্থির) ভারসাম্য।
3. মেটাস্টেবল ভারসাম্য।
ম্যাচবক্স মডেলটি ব্যবহার করে, এটি স্পষ্ট হয়ে যায় যে একটি প্রান্তে (মেটাস্টেবল ভারসাম্য) দাঁড়িয়ে থাকা একটি বাক্সের মাধ্যাকর্ষণ কেন্দ্রটি অবশ্যই উত্থিত হতে হবে যাতে বাক্সটি প্রশস্ত অবস্থার মধ্য দিয়ে প্রশস্ত দিকে পড়ে যায়, যেমন। ভারসাম্যের যান্ত্রিকভাবে স্থিতিশীল অবস্থায়, যা সর্বনিম্ন সম্ভাব্য শক্তির অবস্থাকে প্রতিফলিত করে (চিত্র 9.1.1)।
তাপীয় ভারসাম্য সিস্টেমে তাপমাত্রা গ্রেডিয়েন্টের অনুপস্থিতি দ্বারা চিহ্নিত করা হয়। রাসায়নিক ভারসাম্য তখন ঘটে যখন দুটি পদার্থের মধ্যে কোনো নেট বিক্রিয়া হয় না যা পরিবর্তন ঘটায়, যেমন সমস্ত প্রতিক্রিয়া সামনের দিকে এবং বিপরীত দিকে সমানভাবে দ্রুত ঘটে।
থার্মোডাইনামিক ভারসাম্য বিদ্যমান থাকে যদি সিস্টেমে ভারসাম্যের যান্ত্রিক, তাপীয় এবং রাসায়নিক অবস্থা সন্তুষ্ট হয়। এটি ঘটে যখন মুক্ত শক্তি ন্যূনতম হয়। ধ্রুব চাপে, যেমনটি সাধারণত ধাতুবিদ্যায় গৃহীত হয়, মুক্ত শক্তিকে গিবস মুক্ত শক্তি সি হিসাবে নেওয়া উচিত, যাকে মুক্ত এনথালপি বলা হয়:
এই ক্ষেত্রে, H হল এনথালপি, বা তাপ সামগ্রী, বা অভ্যন্তরীণ শক্তি E এর সমষ্টি এবং চাপ p সহ স্থানচ্যুতি শক্তি pV এবং ভলিউম V অনুযায়ী
ধ্রুব ভলিউম V ধরে নিলে, হেলমহোল্টজ মুক্ত শক্তি F প্রয়োগ করা যেতে পারে:
এই সম্পর্কগুলি থেকে দেখা যাচ্ছে যে ভারসাম্যের অবস্থা চরম মান দ্বারা চিহ্নিত করা হয়। এর মানে হল গিবস মুক্ত শক্তি ন্যূনতম। সমীকরণ (9.1.1) থেকে এটি অনুসরণ করে যে গিবস মুক্ত শক্তি দুটি উপাদান দ্বারা নির্ধারিত হয়, যথা এনথালপি, বা তাপ উপাদান H এবং এনট্রপি এস। এই সত্যটি বিভিন্ন পর্যায়ের অস্তিত্বের তাপমাত্রা নির্ভরতা বোঝার জন্য অপরিহার্য।
তাপমাত্রা পরিবর্তনের সাথে গিবস মুক্ত শক্তির আচরণ বায়বীয়, তরল বা কঠিন পর্যায়ে পদার্থের জন্য ভিন্ন। এর মানে হল যে একটি নির্দিষ্ট পর্যায়ের তাপমাত্রার উপর নির্ভর করে (যা সমষ্টির অবস্থার সমতুল্য), গিবস মুক্ত শক্তি সর্বনিম্ন। এইভাবে, তাপমাত্রার উপর নির্ভর করে, স্থিতিশীল ভারসাম্যে সর্বদা সেই পর্যায় থাকবে যার প্রশ্নে থাকা তাপমাত্রায় গিবস মুক্ত শক্তি অনুরূপভাবে সর্বনিম্ন (চিত্র 9.1.2)।
গিবস মুক্ত শক্তি যে এনথালপি এবং এনট্রপি দ্বারা গঠিত তা টিনের বিভিন্ন পরিবর্তনের অস্তিত্বের অঞ্চলগুলির তাপমাত্রা নির্ভরতার উদাহরণ থেকে স্পষ্ট হয়। সুতরাং, টেট্রাগোনাল (সাদা) β-টিন 13 °সে> তাপমাত্রায় স্থিতিশীল, ঘন হীরার মতো (ধূসর) α-টিন 13 °সে (অ্যালোট্রপি) এর নিচে স্থিতিশীল ভারসাম্যে বিদ্যমান।
যদি, 25 °C এবং 1 বার স্বাভাবিক অবস্থায়, স্থিতিশীল β-ফেজের তাপের পরিমাণ 0 হিসাবে ধরা হয়, তবে ধূসর টিনের জন্য 2 kJ/mol এর তাপ পরিমাণ পাওয়া যায়। 25 ডিগ্রি সেলসিয়াস তাপমাত্রায় তাপের পরিমাণ অনুযায়ী, β-টিনকে α-টিনে রূপান্তরিত করা উচিত 2 kJ/mol রিলিজের পরে, তবে শর্ত থাকে যে কম তাপ সামগ্রী সহ সিস্টেমটি স্থিতিশীল হবে। প্রকৃতপক্ষে, এই ধরনের রূপান্তর ঘটে না, যেহেতু এখানে এনট্রপি প্রশস্ততা বৃদ্ধির মাধ্যমে ফেজ স্থিতিশীলতা নিশ্চিত করা হয়।
স্বাভাবিক অবস্থায় α-tin-এর β-tin-এ রূপান্তরের সময় এনট্রপি বৃদ্ধির কারণে, এনথালপির বৃদ্ধি ক্ষতিপূরণের চেয়ে বেশি, যাতে সাদা β-টিনের পরিবর্তনের জন্য গিবস মুক্ত শক্তি C=H-TS আসলে ন্যূনতম শর্ত পূরণ করে।
শক্তির মতোই, একটি সিস্টেমের এনট্রপিও যৌক্তিকভাবে আচরণ করে, যেমন একটি সিস্টেমের সম্পূর্ণ এনট্রপি পৃথক এনট্রপির যোগফল থেকে গঠিত হয়। এনট্রপি একটি রাষ্ট্রীয় পরামিতি এবং এইভাবে একটি সিস্টেমের অবস্থাকে চিহ্নিত করতে পারে।
সবসময় ন্যায্য
যেখানে Q সিস্টেমে তাপ সরবরাহ করা হয়।
বিপরীত প্রক্রিয়ার জন্য, সমান চিহ্ন গুরুত্বপূর্ণ। একটি adiabatically বিচ্ছিন্ন সিস্টেমের জন্য dQ=0, এইভাবে dS>0। পরিসংখ্যানগতভাবে, এনট্রপিকে এই সত্যের দ্বারা কল্পনা করা যেতে পারে যে কণাগুলিকে মিশ্রিত করার সময় যেগুলি সমানভাবে স্থান পূরণ করে না (যেমন, গ্যাসগুলিকে মিশ্রিত করার সময়), একজাতীয় বন্টনের অবস্থা সম্ভবত, যেমন যতটা সম্ভব এলোমেলোভাবে বিতরণ। এটি সিস্টেমে নির্বিচারে বন্টনের পরিমাপ হিসাবে এনট্রপি এস প্রকাশ করে এবং সম্ভাব্যতার লগারিদম হিসাবে সংজ্ঞায়িত করা হয়:
যেখানে k বোল্টজম্যানের ধ্রুবক; w হল বণ্টনের সম্ভাবনা, উদাহরণস্বরূপ, দুই ধরনের গ্যাসের অণু।
17.01.2020
পঁচিশ থেকে তিন হাজার একশত পঞ্চাশ কিলোওয়াট-অ্যাম্পিয়ার এবং দশ কিলোওয়াট পর্যন্ত ভোল্টেজ ক্লাসের শক্তি সহ কাস্ট ইনসুলেশন উইন্ডিং সহ শুকনো ট্রান্সফরমার...
17.01.2020
ওয়াটারপ্রুফিং কাজ করা একটি প্রয়োজন যা কখনও কখনও গ্যাস, তেল এবং অন্যান্য পাইপলাইন নির্মাণের সময় দেখা দেয়। বাইরের নেতিবাচক প্রভাব থেকে...
17.01.2020
ঢালাই কাজ স্বাস্থ্যের জন্য বিপজ্জনক বলে মনে করা হয়। কাজের সাথে সম্পর্কিত আঘাতের সময় দৃষ্টি ক্রমবর্ধমান ঝুঁকিতে থাকে।
16.01.2020
একটি গুদাম ফর্কলিফ্ট কেনা একটি সহজ প্রক্রিয়া নয়। পছন্দটি একবারে বেশ কয়েকটি মানদণ্ডের ভিত্তিতে করা উচিত। ভুল এড়াতে...
15.01.2020
একটি অ-উদ্বায়ী সিস্টেমের সুবিধা হল যে এটি ব্যবহার করার সময় আপনাকে বিদ্যুৎ বিভ্রাটের বিষয়ে চিন্তা করতে হবে না, এই সিস্টেমটি স্বায়ত্তশাসিতভাবে কাজ করবে এবং...
15.01.2020
আজকাল, বহিরাগত, হালকা ওজনের বাঁশের আসবাবপত্র বিভিন্ন অভ্যন্তরীণ শৈলীতে ব্যবহৃত হয়। আফ্রিকান, জাপানি, পরিবেশগত এবং দেশে বাঁশ বিশেষভাবে সুবিধাজনক দেখায়...
13.01.2020
ঢেউতোলা চাদর একটি অত্যন্ত বহুমুখী উপাদান। এটির কার্যত কোন রক্ষণাবেক্ষণের প্রয়োজন নেই, দেখতে আকর্ষণীয়, ইনস্টল করা খুবই সহজ, টেকসই এবং নির্ভরযোগ্য। ধনী...
13.01.2020
আজ, স্টেইনলেস স্টিলের কাঁচামাল থেকে তৈরি বিভিন্ন পণ্যের বাজারে প্রচুর চাহিদা রয়েছে। এই মুহূর্তে এমন দাবি...
13.01.2020
অ্যাপার্টমেন্ট সংস্কার বিভিন্ন ধরনের আছে. ঠিকাদারী সংস্থার কর্মীদের কাছে আপনার ইচ্ছাগুলি ব্যাখ্যা করার সময় আপনি যাতে সংজ্ঞায় বিভ্রান্ত না হন, প্রথমে আপনার প্রয়োজন...
থার্মোডাইনামিক ইকুইলিব্রিয়াম - থার্মোডাইনামিক অবস্থা। সিস্টেম যা সময়ের সাথে পরিবর্তিত হয় না এবং সিস্টেমের মাধ্যমে পদার্থ বা শক্তি স্থানান্তরের সাথে থাকে না। একটি বিচ্ছিন্ন সিস্টেম যা পরিবেশের সাথে পদার্থ এবং শক্তির বিনিময় করে না সবসময় সময়ের সাথে সাথে তাপগতিগত ভারসাম্য আসে এবং স্বতঃস্ফূর্তভাবে এটি ছেড়ে যেতে পারে না। বাহ্যিক প্রভাব দ্বারা সৃষ্ট অ-ভারসাম্যহীন অবস্থা থেকে তাপগতিগত ভারসাম্যের অবস্থায় একটি সিস্টেমের ধীরে ধীরে রূপান্তর বলা হয় শিথিলকরণ.
থার্মোডাইনামিক ভারসাম্যের মধ্যে রয়েছে: তাপীয় ভারসাম্য - সিস্টেমের আয়তনে ধ্রুবক তাপমাত্রা, তাপমাত্রা গ্রেডিয়েন্টের অনুপস্থিতি; যান্ত্রিক ভারসাম্য, যেখানে সিস্টেমের অংশগুলির কোনও ম্যাক্রোস্কোপিক আন্দোলন সম্ভব নয়, অর্থাৎ সিস্টেমের আয়তনে চাপের সমতা রয়েছে; যাইহোক, সামগ্রিকভাবে সিস্টেমের গতিবিধি অনুমোদিত - বহিরাগত শক্তি এবং ঘূর্ণনের ক্রিয়াকলাপের ক্ষেত্রে অনুবাদমূলক আন্দোলন। একটি ভিন্নধর্মী সিস্টেমের ক্ষেত্রে, তাপগতিগতভাবে ভারসাম্যের পর্যায়গুলির সহাবস্থানকে ফেজ ভারসাম্য বলা হয়। যদি একটি সিস্টেমের উপাদানগুলির মধ্যে রাসায়নিক বিক্রিয়া ঘটে, তাপগতিগত ভারসাম্যের অবস্থায় প্রত্যক্ষ এবং বিপরীত প্রক্রিয়াগুলির হার একে অপরের সমান হয়। সিস্টেমে থার্মোডাইনামিক ভারসাম্যের সময়, সমস্ত অপরিবর্তনীয় স্থানান্তর প্রক্রিয়া (তাপ পরিবাহিতা, প্রসারণ, সান্দ্র প্রবাহ, ইত্যাদি) বন্ধ হয়ে যায়। সিস্টেমে রিঅ্যাক্টেন্টের ঘনত্বের কোন পরিবর্তন নেই; স্টেট প্যারামিটার যা থার্মোডাইনামিক ভারসাম্য নির্ধারণ করে, কঠোরভাবে বলতে গেলে, ধ্রুবক নয়, তবে নির্দিষ্ট পরিসংখ্যানগত গড় মানগুলির চারপাশে ওঠানামা করে; সাধারণত এই ওঠানামাগুলো নগণ্য।
থার্মোডাইনামিক ভারসাম্য শর্ত:
অধীন গঠনের আদর্শ গিবস শক্তিΔG°, স্ট্যান্ডার্ড অবস্থায় একটি পদার্থের 1 মোল গঠনের প্রতিক্রিয়ার সময় গিবস শক্তির পরিবর্তন বুঝুন। এই সংজ্ঞাটি বোঝায় যে স্ট্যান্ডার্ড অবস্থার অধীনে স্থিতিশীল একটি সরল পদার্থ গঠনের স্ট্যান্ডার্ড গিবস শক্তি শূন্য।
গিবস শক্তির পরিবর্তন প্রক্রিয়ার পথের উপর নির্ভর করে না, তাই, সমীকরণ থেকে গিবস শক্তির বিভিন্ন অজানা মান পাওয়া সম্ভব যেখানে একদিকে শক্তির যোগফল প্রতিক্রিয়া পণ্যগুলি লেখা হয়, এবং অন্য দিকে, প্রারম্ভিক পদার্থের শক্তির যোগফল।
স্ট্যান্ডার্ড গিবস শক্তির মান ব্যবহার করার সময়, অ-মানক অবস্থার অধীনে একটি প্রক্রিয়ার মৌলিক সম্ভাবনার মানদণ্ড হল শর্ত ΔG°<0, а критерием принципиальной невозможности - условие ΔG°>0. একই সময়ে, যদি স্ট্যান্ডার্ড গিবস শক্তি শূন্য হয়, তবে এর মানে এই নয় যে বাস্তব পরিস্থিতিতে (মান ছাড়া) সিস্টেমটি ভারসাম্য বজায় থাকবে।
শরীরের মধ্যে ঘটমান exergonic এবং endergonic প্রক্রিয়ার উদাহরণ.
তাপীয় প্রতিক্রিয়া, যার সময় গিবসের শক্তি হ্রাস পায় (dG<0) и совершается работа называются ЭКЗЕРГОНИЧЕСКИМИ(окисление глюкозы дикислородом- C6H12O6+6O2=6CO2+6H2O, dG=-2880 кДж/моль! Реакции в результате которых энергия Гиббса возрастает (dG>0) এবং সিস্টেমে কাজ করাকে ENDERGONIC বলে!
প্রশ্ন 5. রাসায়নিক ভারসাম্য।
রাসায়নিক সাম্যাবস্থা- সিস্টেমের অবস্থা যেখানে সামনের বিক্রিয়ার হার বিপরীত প্রতিক্রিয়ার হারের সমান .
বিপরীত এবং অপরিবর্তনীয় প্রতিক্রিয়া।
সমস্ত রাসায়নিক বিক্রিয়াকে 2টি গ্রুপে ভাগ করা যায়: বিপরীত এবং অপরিবর্তনীয়।
অপরিবর্তনীয় - এগুলি এমন প্রতিক্রিয়া যা এক দিকে সম্পূর্ণ হয়।
বিপরীতমুখী -কে প্রতিক্রিয়া বলা হয় যা সামনে এবং বিপরীত উভয় দিকে বিবেচনাধীন অবস্থায় ঘটতে পারে।
বাম থেকে ডানে ঘটতে থাকা একটি বিক্রিয়াকে বলা হয় ফরোয়ার্ড, এবং ডান থেকে বামে তাকে বিপরীত বলা হয়।
রাসায়নিক ভারসাম্য ধ্রুবক- একটি মান যা একটি প্রদত্ত রাসায়নিকের জন্য নির্ধারণ করে। প্রতিক্রিয়া, রাসায়নিক অবস্থায় প্রাথমিক পদার্থ এবং পণ্যগুলির তাপগতিগত ক্রিয়াকলাপের মধ্যে সম্পর্ক। ভারসাম্য
প্রতিক্রিয়ার জন্য:
ভারসাম্য ধ্রুবক সমতা দ্বারা প্রকাশ করা হয়:

থার্মোডাইনামিক ভারসাম্যের অবস্থা:
তাপমাত্রার উপর প্রতিক্রিয়া ভারসাম্য ধ্রুবকের নির্ভরতা রাসায়নিক বিক্রিয়ার আইসোবার সমীকরণ দ্বারা বর্ণনা করা যেতে পারে ( আইসোবারভ্যান হফ):
![]()
রাসায়নিক বিক্রিয়া আইসোথার্ম সমীকরণ।
রাসায়নিক বিক্রিয়ার আইসোথার্মের সমীকরণটি সিস্টেমের যেকোনো অবস্থা থেকে সাম্যাবস্থায় স্থানান্তরের সময় গিবস শক্তি ΔG (ΔF) এর মান গণনা করা সম্ভব করে তোলে, যেমন বিকারকগুলির প্রদত্ত ঘনত্ব C i (চাপ P i) এ রাসায়নিক বিক্রিয়া স্বতঃস্ফূর্তভাবে এগিয়ে যাবে কিনা প্রশ্নের উত্তর দাও:
সিস্টেমকে প্রভাবিত করে যখন প্রারম্ভিক পদার্থ এবং প্রতিক্রিয়া পণ্যগুলির ভারসাম্যের ঘনত্ব পরিবর্তিত হয়, তখন রাসায়নিক ভারসাম্যের একটি পরিবর্তন ঘটে।
লে চ্যাটেলিয়ারের নীতি ব্যবহার করে ভারসাম্য পরিবর্তনের প্রকৃতি অনুমান করা যেতে পারে:
যখন প্রারম্ভিক পদার্থগুলির মধ্যে একটির ঘনত্ব বৃদ্ধি পায়, তখন ভারসাম্য প্রতিক্রিয়া পণ্যগুলির গঠনের দিকে চলে যায়;
যখন প্রতিক্রিয়া পণ্যগুলির একটির ঘনত্ব হ্রাস পায়, তখন ভারসাম্য শুরুর পদার্থের গঠনের দিকে চলে যায়।
তাপমাত্রা বাড়ার সাথে সাথে রাসায়নিক ভারসাম্য এন্ডোথার্মিক বিক্রিয়ার দিকে এবং তাপমাত্রা কমার সাথে সাথে এক্সোথার্মিক বিক্রিয়ার দিকে সরে যায়।
চাপ বাড়ার সাথে সাথে ভারসাম্য সেই দিকে সরে যায় যেখানে গ্যাসের মোট মোল সংখ্যা কমে যায় এবং এর বিপরীতে।
ভারসাম্য পরিবর্তনের পূর্বাভাস দেওয়ার জন্য সাধারণ নীতি:
একটি ভারসাম্য ব্যবস্থার উপর যে কোন ফ্যাক্টরের প্রভাব ভারসাম্যের একটি দিক পরিবর্তনকে উদ্দীপিত করে যা স্থানচ্যুতির মূল বৈশিষ্ট্যগুলি পুনরুদ্ধার করতে সহায়তা করে।
হোমিওস্ট্যাসিস -প্রাণী এবং মানবদেহের জটিল অভিযোজিত প্রতিক্রিয়াগুলির একটি সেট, শরীরের বাহ্যিক বা অভ্যন্তরীণ পরিবেশের বিভিন্ন কারণের প্রভাবকে নির্মূল বা সর্বাধিক করার লক্ষ্যে . শরীরের অভ্যন্তরীণ অবস্থার স্থায়িত্ব বজায় রাখার ক্ষমতা।
স্থির অবস্থা- এটি জীবন্ত বস্তুর একটি সাধারণ অবস্থা। এটি একটি ধ্রুবক শক্তি স্তর দ্বারা চিহ্নিত করা হয়, এবং এনট্রপির পরিবর্তন শূন্যের দিকে থাকে। সমস্ত মৌলিক শারীরবৃত্তীয় প্রক্রিয়া সিস্টেমের একটি স্থির অবস্থায় উপলব্ধি করা হয়।