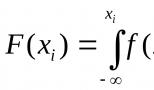Скорость реакции в химическом анализе. Факторы, влияющие на скорость химической реакции
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ:
V = ± ((С 2 - С 1) / (t 2 - t 1)) = ± (DС / Dt)
Где С 1 и С 2 - молярные концентрации веществ в моменты времени t 1 и t 2 соответственно (знак (+) - если скорость определяется по продукту реакции, знак (-) - по исходному веществу).
Реакции происходят при столкновении молекул реагирующих веществ. Ее
скорость определяется количеством столкновений и вероятностью того, что
они приведут к превращению. Число столкновений определяется
концентрациями реагирующих веществ, а вероятность реакции - энергией
сталкивающихся молекул.
Факторы, влияющие на скорость химических реакций.
1. Природа реагирующих веществ.
Большую роль играет характер химических связей и строение молекул
реагентов. Реакции протекают в направлении разрушения менее прочных
связей и образования веществ с более прочными связями. Так, для разрыва
связей в молекулах H 2 и N 2 требуются высокие энергии; такие молекулы мало реакционноспособны. Для разрыва связей в сильнополярных молекулах (HCl, H 2 O)
требуется меньше энергии, и скорость реакции значительно выше. Реакции
между ионами в растворах электролитов протекают практически мгновенно.
Примеры
Фтор с водородом реагирует со взрывом при комнатной температуре, бром с водородом взаимодействует медленно и при нагревании.
Оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид меди - не реагирует.
2. Концентрация. С увеличением
концентрации (числа частиц в единице объема) чаще происходят
столкновения молекул реагирующих веществ - скорость реакции возрастает.
Закон действующих масс (К. Гульдберг, П.Вааге, 1867г.)
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
AA + bB + . . . ® . . .
- [A] a [B] b . . .
Константа скорости реакции k зависит
от природы реагирующих веществ, температуры и катализатора, но не
зависит от значения концентраций реагентов.
Физический смысл константы скорости
заключается в том, что она равна скорости реакции при единичных
концентрациях реагирующих веществ.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
3. Температура. При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа). При увеличении температуры от t 1 до t 2 изменение скорости реакции можно рассчитать по формуле:
| |
|
(t 2 - t 1) / 10 |
| Vt 2 / Vt 1 | = g | |
(где Vt 2 и Vt 1 - скорости реакции при температурах t 2 и t 1 соответственно; g- температурный коэффициент данной реакции).
Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса:
- e -Ea/RT
где
A - постоянная, зависящая от природы реагирующих веществ;
R - универсальная газовая постоянная ;
Ea - энергия активации, т.е. энергия, которой должны обладать
сталкивающиеся молекулы, чтобы столкновение привело к химическому
превращению.
Энергетическая диаграмма химической реакции.
| Экзотермическая реакция | Эндотермическая реакция |
А - реагенты, В - активированный комплекс (переходное состояние), С - продукты.
Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры.
4. Поверхность соприкосновения реагирующих веществ. Для гетерогенных систем (когда вещества находятся в разных агрегатных состояниях), чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения.
5. Катализ. Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами . Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии), при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях). Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление "отрицательного катализа ").
Знание скоростей химический реакций имеет большое теоретическое и практическое значение. Например, в химической промышленности при производстве вещества от скорости реакции зависят размеры и производительность аппаратуры, количество получаемого продукта.
У разных химических реакций разная скорость. Некоторые реакции протекают в течение долей секунды, для осуществления других нужны месяцы, а то и годы. Скорость протекания химических реакций изучает химическая кинетика .
Основные понятия, с которыми оперирует химическая кинетика - это химическая система и фаза :
- Химическая система - вещество (совокупность веществ);
- Химическая фаза - часть системы, отделенная от других частей поверхностью раздела .
Системы, состоящие из одной фазы, называются однородными или гомогенными , например, газовые смеси или растворы. Реакции, протекающие в гомогенных системах, называются гомогенными реакциями , такие реакции протекают во всем объеме смеси.
Системы, состоящие из нескольких фаз, называютя неоднородными или гетерогенными , например, жидкость+твердое вещество. Реакции, протекающие в гетерогенных системах, называются гетерогенными реакциями , такие реакции протекают толькло на поверхности раздела фаз.
Скорость гомогенной реакции
Скоростью гомогенной реакции называют кол-во вещества (ν), образующегося в результате реакции за единицу времени (t) в единице объема системы (V):
- ν 1 - кол-во молей вещества в момент времени t 1 ;
- ν 2 - кол-во молей вещества в момент времени t 2 ;
Мольно-объемная концентрация вещества (С, моль/л) - отношение кол-ва молей вещества (ν) ко всему объему реакционной смеси (V): С=ν/V .
Скорость гомогенной реакции равна изменению концентрации реагирующего вещества в единицу времени.
В том случае, если речь идет о концентрации одного из продуктов реакции, в выражении ставится знак "плюс", если о концентрации одного из искодных веществ - знак "минус".
Скорость гетерогенной реакции
Как уже было сказано выше, главное отличие гетерогенных реакций от гомогенных заключается в том, что реакция происходит на границе раздела фаз.
Скоростью гетерогенной реакции (v гет) называется кол-во вещества (ν), образующегося за единицу времени (t) на единице поверхности раздела фаз (S).
Основные факторы, влияющие на скорость реакций:
- природа реагирующих веществ;
- концентрация;
- температура;
- катализаторы;
- размеры частиц реагентов;
- давление.
Последние два пункта относятся к гетерогенным реакциям.
Природа реагирующих веществ
Необходимым условием химического взаимодействия между молекулами веществ является их столкновение друг с другом на "нужном" участке молекулы, называемом участком с высокой реакционной активностью . Это как в боксе: если удар боксера приходится в перчатки соперника, то реакции не будет; а вот если удар приходится в голову соперника, то вероятность нокаута (реакции) значительно возрастает; а если при этом сила удара (сила соударений молекул) велика, то нокаут (реакция) становится неизбежным.
Исходя из вышесказанного, можно сделать вывод, чем сложнее молекула, тем ее высокореактивный участок меньше. Отсюда, чем больше и сложнее молекулы реагирующих веществ, тем меньше скорость реакции.
Концентрация реагентов
Скорость реакции прямо пропорциональна числу соударений молекул. Чем выше концентрация реагентов, тем больше соударений, тем выше скорость химической реакции. Например, горение в чистом кислороде происходит гораздо быстрее, чем на обыкновенном воздухе.
Однако, следует сказать, что в сложных реакциях, протекающие в несколько стадий; такая зависимость не соблюдается. Это позволяет определить какой из реагентов не задействован в самой медленной стадии реакции, которая и определяет саму скорость реакции.
Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действующих масс , который был открыт в 1867 г. норвежскими учеными Гульдбергом и Вааге.
Скорость (v) условной реакции, описываемой уравнением aA+bB=cC+dD , в соответствии с законом действующих масс, будет вычисляться по формуле, которая носит название кинетического уравнения реакции :
V=k·[A] a ·[B] b
- [A], [B] - концентрации исходных веществ;
- k - константа скорости реакции, равная скорости данной реакции при концентрациях реагирующих веществ, равной 1 моль каждая.
k не зависит от концентрации реагирующих веществ, но зависит от их природы и температуры.
По кинетическому уравнению реакции можно определить скорость изменения реакции в зависимости от изменения концентрации реагирующих веществ.
Примеры кинетических уравнений:
2SO 2 (г)+O 2 (г)=2SO 3 (г) v=k· 2 · CuO(т)+H 2 (г)=Cu(т)+H 2 O(г) v=k·
Обратите внимание, что в кинетические уравнения не входят концентрации твердых веществ, а только газообразных и растворенных.
Температура реагентов
При повышении температуры молекулы движутся быстрее, отсюда возрастает количество их соударений друг с другом. Кроме этого, увеличивается кинетическая энергия молекул, что повышает эффективность соударений, которые в конечном счете и определяют скорость реакции.
Согласно теории активации , в химической реакции могут принять участие лишь молекулы, обладающие энергией, которая превышает некую среднюю величину. Величина превышения средней энергии молекул носит название энергии активации . Эта энергия необходима для ослабления химических связей в молекулах исходных веществ. Молекулы, обладающие необходимой избыточной энергией, что позволяет им вступать в реакцию, называются активными молекулами . Чем выше температура, тем больше активных молекул, тем выше скорость реакции.
Зависимость скорости реакции от температуры характеризуется правилом Вант-Гоффа :
Математически правило Вант-Гоффа выражается следующей формулой:
- γ - температурный коэффициент, показывающий увеличение скорости реакции при повышении температуры на 10°C;
- v 1 - скорость реакции при температуре t 1 ;
- v 2 - скорость реакции при температуре t 2 ;
Катализаторы
Катализаторы - это вещества, которые влияют на скорость реакции, но при этом сами не расходуются.
Реакции, протекающие с участием катализаторов, носят название каталитических реакций .
Основное действие катализатора - снижение энергии активации реакции , в результате чего возрастает количество эффективных соударений молекул.
Катализаторы могут ускорять реакцию в миллионы раз!
Различают два вида катализа:
- гомогенный (однородный) катализ - катализатор и реагенты образуют одну фазу: газ или раствор;
- гетерогенный (неоднородный) катализ - катализатор находится в виде самостоятельной фазы.
Механизм каталитических реакций очень сложен и до конца неизвестен. Согласно одной из научных гипотез, в каталитических реакциях катализатор и реагент вступают в реакцию с образованием промежуточного соединения, которое гороаздо активнее реагирует с другим исходным веществом с образованием конечного продукта реакции, при этом сам катализатор выделяется в свободном состоянии.
Обычно под катализаторами понимают вещества, ускоряющие реакцию, но есть вещества, замедляющие течение реакции - они называются ингибиторами .
Биологические катализаторы называются ферментами . Ферменты являются белками.
Размер частиц реагентов
Возьмем спичку и поднесем ее к куску угля. Вряд ли уголь успеет загореться, пока спичка не погаснет. Измельчим уголь и повторим эксперимент - угольная пыль не просто загорится, а очень быстро загорится - произойдет взрыв (основная опасность в угольных шахтах). Что же происходит?
Измельчив уголь, мы тем самым резко увеличим площадь его поверхности. Чем больше площадь поверхности, на которой происходят столкновения молекул, тем выше скорость реакции.
Давление реагентов
Давление газообразных реагентов аналогично их концентрации - чем выше давление - тем выше концентрация - тем выше скорость реакции, т.к. количество соударений молекул возрастает. Как и концентрация, давление реагентов не "работает" в сложных реакциях.
Скорость химической реакции зависит от многих факторов, включая природу реагирующих веществ, концентрацию реагирующих веществ, температуру, наличие катализаторов. Рассмотрим эти факторы.
1). Природа реагирующих веществ . Если идёт взаимодействие между веществами с ионной связью, то реакция протекает быстрее, чем между веществами с ковалентной связью.
2.) Концентрация реагирующих веществ . Чтобы прошла химическая реакция, необходимо столкновение молекул реагирующих веществ. То есть молекулы должны настолько близко подойти друг к другу, чтобы атомы одной частицы испытывали на себе действие электрических полей другой. Только в этом случае будут возможны переходы электронов и соответствующие перегруппировки атомов, в результате которых образуются молекулы новых веществ. Таким образом, скорость химических реакций пропорциональна числу столкновений, которое происходит между молекулами, а число столкновений, в свою очередь, пропорционально концентрации реагирующих веществ. На основании экспериментального материала норвежские учёные Гульдберг и Вааге и независимо от них русский учёный Бекетов в 1867 году сформулировали основной закон химической кинетики – закон действующих масс (ЗДМ): при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степени их стехиометрических коэффициентов. Для общего случая:
закон действующих масс имеет вид:
Запись закона действующих масс для данной реакции называют основным кинетическим уравнением реакции . В основном кинетическом уравнении k – константа скорости реакции, которая зависит от природы реагирующих веществ и температуры.
Большинство химических реакций является обратимыми. В ходе таких реакций продукты их по мере накопления реагируют друг с другом с образованием исходных веществ:
Скорость прямой реакции:
Скорость обратной реакции:
В момент равновесия:
Отсюда закон действующих масс в состоянии равновесия примет вид:
где K – константа равновесия реакции.
3) Влияние температуры на скорость реакции . Скорость химических реакций, как правило, при превышении температуры возрастает. Рассмотрим это на примере взаимодействия водорода с кислородом.
2Н 2 + О 2 = 2Н 2 О
При 20 0 С скорость реакции практически равна нулю и понадобилось бы 54 млрд.лет, чтобы взаимодействие прошло на 15%. При 500 0 С для образования воды потребуется 50 минут, а при 700 0 С реакция протекает мгновенно.
Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа : при увеличении температуры на 10 о скорость реакции увеличивается в 2 – 4 раза. Правило Вант-Гоффа записывается:
4) Влияние катализаторов . Скорость химических реакций можно регулировать с помощью катализаторов – веществ, изменяющих скорость реакции и остающихся после реакции в неизменном количестве. Изменение скорости реакции в присутствии катализатора называется катализом. Различают положительный (скорость реакции увеличивается) и отрицательный (скорость реакции уменьшается) катализ. Иногда катализатор образуется в ходе реакции, такие процессы называют автокаталитическими. Различают гомогенный и гетерогенный катализ.
При гомогенном катализе катализатор и реагирующие вещества находятся в одной фазе. Например:
При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах. Например:
Гетерогенный катализ связан с ферментативными процессами. Все химические процессы, протекающие в живых организмах, катализируются ферментами, которые представляют собой белки с определёнными специализированными функциями. В растворах, в которых идут ферментативные процессы, нет типичной гетерогенной среды, в связи с отсутствием чётко выраженной поверхности раздела фаз. Такие процессы относят к микрогетерогенному катализу.
Скорость химической реакции – это изменение концентрации реагирующих веществ в единицу времени.
При гомогенных реакциях пространством реакции обозначается объем реакционного сосуда, а при гетерогенных — поверхность, на которой протекает реакция. Концентрацию реагирующих веществ обычно выражают в моль/л — количестве молей вещества в 1 литре раствора.
Скорость химической реакции зависит от природы реагирующих веществ, концентрации, температуры, давления, поверхности соприкосновения веществ и ее характера, присутствия катализаторов.


Увеличение концентрации веществ, вступающих в химическое взаимодействие, приводит к увеличению скорости химической реакции. Это происходит потому, что все химические реакции проходят между некоторым количеством реагирующих частицами (атомами, молекулами, ионами). Чем больше этих частичек в объеме реакционного пространства, тем чаще они соударяются и происходит химическое взаимодействие. Химическая реакция может протекать через один или несколько элементарных актов (соударений). На основании уравнения реакции можно записать выражение зависимости скорости реакции от концентрации реагирующих веществ. Если в элементарном акте участвует лишь одна молекула (при реакции разложения), зависимость будет иметь такой вид:
v = k*[A]
Это уравнение мономолекулярной реакции. Когда в элементарном акте происходит взаимодействие двух разных молекул, зависимость имеет вид:
v = k*[A]*[B]
Реакция называется бимолекулярной. В случае соударения трех молекул справедливо выражение:
v = k*[A]*[B]*[C]
Реакция называется тримолекулярной. Обозначения коэффициентов:
v — скорость реакции;
[А], [В], [С] — концентрации реагирующих веществ;
k — коэффициент пропорциональности; называется константой скорости реакции.
Если концентрации реагирующих веществ равны единице (1 моль/л) или их произведение равно единице, то v = k.. Константа скорости зависит от природы реагирующих веществ и от температуры. Зависимость скорости простых реакций (т. е. реакций, протекающих через один элементарный акт) от концентрации описывается законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, возведенных в степень их стехиометрических коэффициентов.
Для примера разберем реакцию 2NO + O 2 = 2NO 2 .
В ней v = k* 2 *
В случае, когда уравнение химической реакции не соответствует элементарному акту взаимодействия, а отражает лишь связь между массой вступивших в реакцию и образовавшихся веществ, то степени у концентраций не будут равны коэффициентам, стоящим перед формулами соответствующих веществ в уравнении реакции. Для реакции, которая протекает в несколько стадий, скорость реакции определяется скоростью самой медленной (лимитирующей) стадии.
Такая зависимость скорости реакции от концентрации реагирующих веществ справедлива для газов и реакций, проходящих в растворе. Реакции с участием твердых веществ не подчиняются закону действующих масс, так как взаимодействие молекул происходит лишь на поверхности раздела фаз. Следовательно, скорость гетерогенной реакции зависит еще и от величины и характера поверхности соприкосновения реагирующих фаз. Чем больше поверхность – тем быстрее будет идти реакция.
Влияние температуры на скорость химической реакции
Влияние температуры на скорость химической реакции определяется правилом Вант-Гоффа: при повышении температуры на каждые 10 ° C скорость реакции увеличивается в 2-4 раза. Математически это правило передается следующим уравнением:
v t2 = v t1 * g (t2-t1)/10
где v t1 и v t2 — скорости реакций при температурах t2 и t1; g — температурный коэффициент реакции — число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на каждые 10 ° C. Такая значительная зависимость скорости химической реакции от температуры объясняется тем, что образование новых веществ происходит не при всяком столкновении реагирующих молекул. Взаимодействуют только те молекулы (активные молекулы), которые обладают достаточной энергией, чтобы разорвать связи в исходных частицах. Поэтому каждая реакция характеризуется энергетическим барьером. Для его преодоления молекуле необходима энергия активации — некоторая избыточная энергия, которой должна обладать молекула для того, чтобы ее столкновение с другой молекулой привело к образованию нового вещества. С ростом температуры число активных молекул быстро увеличивается, что приводит в резкому возрастанию скорости реакции по правилу Вант-Гоффа. Энергия активации для каждой конкретной реакции зависит от природы реагирующих веществ.
Теория активных столкновений позволяет объяснить влияние некоторых факторов на скорость химической реакции. Основные положения этой теории:
- Реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией.
- Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
- К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Для этого частицы должны обладать достаточной энергией.
- Минимальный избыток энергии, необходимый для эффективного соударения частиц реагентов, называется энергией активации Еа.
- Активность химических веществ проявляется в низкой энергии активации реакций с их участием. Чем ниже энергия активации, тем выше скорость реакции. Например, в реакциях между катионами и анионами энергия активации очень мала, поэтому такие реакции протекают почти мгновенно
Влияние катализатора
Одно из наиболее эффективных средств воздействия на скорость химических реакций — использование катализаторов. Катализаторы — это вещества, которые изменяют скорость реакции, а сами к концу процесса остаются неизменными по составу и по массе. Иначе говоря, в момент самой реакции катализатор активно участвует в химическом процессе, но к концу реакции реагенты изменяют свой химический состав, превращаясь в продукты, а катализатор выделяется в первоначальном виде. Обычно роль катализатора заключается в увеличении скорости реакции, хотя некоторые катализаторы не ускоряют, а замедляют процесс. Явление ускорения химических реакций благодаря присутствию катализаторов носит название катализа, а замедления — ингибирования.
Некоторые вещества не обладают каталитическим действием, но их добавки резко увеличивают каталитическую способность катализаторов. Такие вещества называются промоторами . Другие вещества (каталитические яды) уменьшают или даже полностью блокируют действие катализаторов, этот процесс называется отравлением катализатора .
Существуют два вида катализа: гомогенный и гетерогенный . При гомогенном катализе реагенты, продукты и катализатор составляют одну фазу (газовую или жидкую). В этом случае отсутствует поверхность раздела между катализатором и реагентами.
Особенность гетерогенного катализа состоит в том, что катализаторы (обычно твердые вещества) находятся в ином фазовом состоянии, чем реагенты и продукты реакции. Реакция развивается обычно на поверхности твердого тела.
При гомогенном катализе происходит образование промежуточных продуктов между катализатором и реагирующим веществом в результате реакции с меньшим значением энергии активации. При гетерогенном катализе увеличение скорости объясняется адсорбцией реагирующих веществ на поверхности катализатора. В результате этого их концентрация увеличивается и скорость реакции растет.
ХИМИЧЕСКАЯ КИНЕТИКА И
Химической кинетикой называется учение о скорости протекания химических процессов. Краткое изложение основ химической кинетики и составляет содержание настоящей главы.
Скорость химических реакций
Изучение химических реакций показывает, что они могут протекать с весьма различными скоростями. Иногда реакция идет настолько быстро, что практически ее можно считать мгновенной; таковы, например, многие реакции между солями, кислотами и основаниями, протекающие в водных растворах, или реакции, которые мы называем взрывами. В других случаях, наоборот, скорость реакции так мала, что для образования заметного количества продуктов реакции нужны были бы годы, а и столетия.
Скорость реакции измеряется изменением концентраций реагирующих веществ в единицу времени.
Концентрацией называется количество в единице объема. При измерении скоростей реакций концентрации обычно выражаются числом молей , содержащихся в 1 л.
Положим, что в некоторый момент времени концентрация какого-либо из реагирующих веществ равнялась 2 молям на 1 л, а спустя минуту стала равной 1,8 моля на 1 л, т. е. уменьшилась на 0,2 моля. Уменьшение концентрации свидетельствует о том, что из того количества данного , которое содержалось в 1 л, в течение минуты прореагировало 0,2 моля. Следовательно, величина изменения концентрации может служить мерой количества вещества, подвергающегося превращению в единицу времени, т. е. мерой скорости реакции. На этом основании скорость реакции выражают числом молей, подвергающихся превращению в единицу времени, относя это число к 1 л. В данном случае скорость реакции будет равна 0,2 моля в минуту. Так как вещества реагируют в эквивалентных количествах, о скорости реакции можно судить по изменению концентрации любого из реагирующих веществ.
Скорость каждой реакции зависит от природы реагирующих веществ, от их концентраций и от условий, в которых реакция протекает (температура, давление, присутствие катализаторов).
Зависимость скорости реакции от концентраций реагирующих веществ легко понять, исходя из молекулярно-кинетичеоких представлений. Рассмотрим в виде примера реакцию между двумя газообразными веществами, смешанными в известном объеме при определенной температуре.
Молекулы газов, двигаясь в различных направлениях с довольно большой скоростью, неизбежно должны встречаться сталкиваться друг с другом. Взаимодействие между молекулами, очевидно, может происходить только при их столкновениях; следовательно, чем чаще будут сталкиваться молекулы, тем быстрее будет идти превращение взятых веществ в новые, тем больше будет скорость реакции. Частота же столкновений молекул прежде всего зависит от числа их в единице объема, т. е. от концентраций реагирующих веществ.
Не следует думать, что каждое столкновение между молекулами обязательно приводит к образованию новых молекул. Кинетическая теория позволяет вычислить, сколько столкновений должно произойти в единицу времени при данных концентрации и температуре реагирующих веществ; а экспериментальное определение скорости реакции показывает, сколько молекул в действительности подвергается превращению, за тот же промежуток времени. Последнее число всегда оказывается меньше первого. Очевидно, среди молекул имеется некоторое количество более «активных», т. е. обладающих в момент столкновения большей энергией; только при столкновении таких активных молекул и происходит химическое взаимодействие, другие же молекулы расходятся после столкновения неизменёнными. Но каково бы ни было относительное количество активных молекул в каждом отдельном случае, абсолютное их число в единице объема, а следовательно и число эффективных столкновений, будет расти с увеличением концентрации, поэтому будет возрастать и скорость реакции.
Попробуем теперь установить количественную зависимость между скоростью реакции и концентрациями реагирующих веществ. Для этого рассмотрим какую-либо конкретную реакцию, например реакцию образования йодистого водорода из иода и водорода:
Н 2 + J 2 = 2HJ
Предположим, что мы смешали в сосуде при некоторой температуре равные объемы водорода и паров иода и сжали смесь так, что концентрация каждого газа стала равна 0,1 моль/л. Начинается реакция. Пусть при этих условиях в 1 мин. подвергается превращению в HJ по 0,0001 моля Н 2 и J 2 , т. е. скорость реакции равна 0,0001 моля в 1 мин. Если увеличить концентрацию одного из газов, например водорода, в два, три или четыре
раза (вводя соответствующее количество его в тот же сосуд), очевидно, и число столкновений между молекулами Н 2 и J 2 в единицу времени увеличится во столько же раз, а следовательно, во столько же раз возрастет и скорость реакции между ними. При одновременном увеличении концентраций обоих газов, одного, положим, в два раза, а другого в четыре раза, скорость реакции увеличится уже в восемь раз и станет равной: 0,0001 2 4 = 0,0008 моля в минуту. Таким образом, мы приходим к следующему выводу:
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Это очень важное положение было установлено в 1867 г. двумя норвежскими учеными - Гульдбером и Вааге и получило название закона действия масс или закона действующих масс.
Переходя к математическому выражению закона действия масс, начнем с простейших реакций, при которых, как и при образовании HJ, одна молекула одного вещества взаимодействует с одной молекулой другого. Поскольку нас сейчас интересуют только вступающие в реакцию вещества, мы можем изобразить такие реакции общим уравнением
А + В = С
Обозначая концентрации вещества А и В соответственно через [А] и [В], а скорость реакции при данных концентрациях через v , получим: υ = К ∙ [A] ∙ [В]
где K - коэффициент пропорциональности - постоянная для данной реакции при данной температуре величина, называемая константой скорости и характеризующая влияние природы реагирующих веществ на скорость их взаимодействия друг с другом.
Если принять в написанном выше уравнении, что [А] = 1 и [В] = 1, то
υ = К
Отсюда видно, что константа скорости К численно равна скорости реакции, когда концентрации реагирующих веществ (или их произведение) равны единице.
Несколько иной вид имеет выражение для скорости реакции, когда во взаимодействие вступает не одна, а несколько молекул какого-нибудь вещества, например:
2А + В = D или А + А + В = D
Чтобы это взаимодействие могло осуществиться, должно произойти одновременное столкновение двух молекул А и одной молекулы В. Математический анализ показывает, что концентрация вещества А должна в таком случае дважды появиться в уравнении скорости реакции:
υ = К ∙ [А]∙[А]∙[В]= К∙[А] 2 ∙ [В]
В общем случае, когда т молекул вещества А одновременно реагируют с молекулами вещества В, уравнение скорости реакции имеет вид:
υ = К ∙ [А] т ∙ S [В] п
Следующие конкретные примеры иллюстрируют сказанное:
Н 2 +J 2 = 2HJ
υ = К [Н 2 ] ∙ 2NO + О 2 = 2NО 2
υ = К 2 ∙ [О 2 ]
Скорость всякой реакции непрерывно уменьшается с течением времени, так как взаимодействующие вещества постепенно расходуются и концентрации их становятся все меньше и меньше. Поэтому, говоря о скорости реакции, всегда имеют в виду скорость в данный момент, т. е. то количество вещества, которое подверглось бы превращению, если бы существующие в данный момент концентрации поддерживались искусственно в течение определенного промежутка времени.
Все выводы относительно зависимости скорости реакции от концентраций реагирующих веществ не распространяются на участвующие в реакции твердые вещества. Так как твердые вещества реагируют только с поверхности, то в данном случае скорость реакции зависит не от объемной концентрации, а от величины поверхности твердого вещества; поэтому если в реакции наряду, с газами и растворенными веществами участвуют также и твердые вещества, то скорость реакции (при данной степени дробления твердого вещества) изменяется только в зависимости от концентраций газообразных или растворенных веществ. Например, скорость реакции горения угля
С + O 2 = СO 2
будет пропорциональна только концентрации кислорода:
C + O 2 = CO 2
На практике при измерении скоростей реакций часто приходится встречаться с кажущимися отклонениями от закона действия масс. Это объясняется тем, что многие реакции протекают в несколько стадий, т. е распадаются на несколько последовательных более простых процессов. Закон действия масс справедлив в этом случае для каждого
отдельного элементарного процесса, но не для всей реакции в целом. Так, например, реакция между йодноватой кислотой HJO3 и сернистой кислотой H 2 SO 3 выражается суммарным уравнением
HJО 3 + 3H 2 SO 3 = HJ + 3H 2 SO 4
скорость же этой реакции согласно измерениям возрастает не пропорционально кубу концентрации H 2 SO 3 , а почти точно пропорционально ее первой степени, что как бы противоречит закону действия масс. Допустим, однако, что рассматриваемая реакция протекает в две стадии таким образом, что сперва HJO 3 медленно превращается в йодистую кислоту HJO 2 по уравнению
HJO 3 + H 2 SO 3 = HJO 2 + H 2 SO 4
а затем HJO 2 очень быстро взаимодействует с H 2 SO 3 , образуя HJ и H 2 SO 4:
HJO 2 + 2H 2 SO 3 = HJ + 2H 2 SO 4
В таком случае наблюдаемая скорость реакции, очевидно, будет определяться скоростью первого, медленного процесса, т. е. согласно закону действия масс она должна возрастать пропорционально первой, а не третьей степени концентрации H 2 SO 3 . (В действительности эта реакция протекает еще сложнее.)
Исследованиями установлено, что большинство газовых реакций протекает очень сложно и не подчиняется закону действия масс в простой форме. Поэтому на основании обычного химического уравнения без действительного изучения механизма реакции нельзя еще с уверенностью судить о том, как будет изменяться скорость данной реакции в зависимости от концентраций.
Выяснению механизма химических реакций - основного вопроса химической кинетики - были посвящены исследования русского ученого Н. А. Шилова, изучавшего кинетику химических реакций в растворах, в частности механизм так называемых «сопряженных реакций».
Если из двух реакций с одним общим участником
(I) А + В→М и (II) A + C → N
вторая идет лишь при протекании первой, то такие две реакции называются сопряженными. Участвующее в той и другой реакции вещество А называется актором. Вещество В, непосредственно реагирующее с актором, носит название индуктора, а вещество С, реагирующее с А только в присутствии индуктора, называется а к цептором.
При сопряженных реакциях индуктор действует подобно катализатору, вызывая реакцию, которая в его отсутствие не происходит. Следует, однако, строго отличать индуктор от катализатора: первый расходуется во время реакции, а второй - нет.
Кроме концентрации, очень важным фактором, определяющим скорость реакции, является температура. Опытным путем установлено, что при повышении температуры на каждые 10° скорость реакции увеличивается в два-три раза. При понижении температуры скорость реакции во столько же раз уменьшается. Число, показывающее, во сколько раз увеличивается скорость данной реакции при повышении температуры на 10°, называется температурным коэффициентом реакции.
Принимая температурный коэффициент реакции равным двум, нетрудно рассчитать, что если, например, при 0° реакция закан чивается в 10 мин., то при 100° она закончится уже в 0,6 сек.
Наоборот, реакция, заканчивающаяся при 100° в 10 мин., при 0° потребует для своего окончания около 7 дней. Отсюда понятно, что многие реакции, быстро протекающие при высоких темпера турах, при обыкновенной температуре идут настолько медленно, что нам кажется, будто они совсем не происходят (например образование воды из водорода и кислорода).
Значительное увеличение скорости реакции при повышении температуры нельзя объяснить одним только увеличением числа столкновений между молекулами. Согласно кинетической теории, скорость движения молекул растет пропорционально корню квадратному из абсолютной температуры, тогда как скорость реакции увеличивается гораздо быстрее. Следует считать, что повышение температуры не только вызывает более частые столкновения, но и увеличивает число эффективных столкновений, в результате которых происходит химическое взаимодействие, т. е. увеличивает относительное количество активных молекул. Это может быть объяснено тем, что по мере повышения температуры молекулы становятся менее устойчивыми и, следовательно, более склонными к химической реакции.
Наконец, третьим фактором, оказывающим огромное влияние на скорость реакции, является присутствие катализаторов - веществ, которые изменяют скорость реакции, но сами после реакции остаются химически неизмененными и в том же количестве, что и до реакции. Обычно влияние катализаторов выражается в ускорении реакции. Иногда катализатор может увеличить скорость реакции в 1000 и более раз. Чаще всего катализа-торами служат мелко раздробленные .
Рассматривая влияние различных условий на скорость реакций, мы разбирали главным образом реакции, идущие в однород-ных, или г омогенных, системах (смесь газов, растворы). Значительно сложнее протекают реакции в гетерогенных системах.
Гетерогенной называется система, состоящая из двух или нескольких частей, различающихся по своим физическим^или химическим свойствам и отделенных друг от друга поверхностями раздела. Отдельные однородные части гетерогенной системы называются ее фазами. Например, лед, и находящийся над ними пар образуют гетерогенную систему из трех фаз: твердой (лед), жидкой () и газообразной (водяной пар); кислота и опущенный в нее кусок металла образуют систему из двух фаз и т. д.
В гетерогенной системе реакция всегда происходит на по верхности раздела двух фаз, так как только здесь молекулы той и другой фазы сталкиваются между собой. Поэтому око-
рость гетерогенной реакции зависит не только от рассмотренных нами раньше трех факторов, но и от величины поверхности соприкосновения между реагирующими фазами. Всякое увеличение поверхности приводит и к увеличению скорости реакции. Так, например, измельченный уголь, обладающий большой поверхностью, cгopает гораздо быстрее, чем уголь в крупных кусках; растворение металлов в кислотах значительно ускоряется, если взять в виде порошков, и т. д. Важным фактором, обусловливающим скорость гетерогенной реакции, является также диффузия, благодаря которой к поверхности раздела притекают новые порции реагирующих веществ. Искусственно ускоряя процесс диффузии встряхиванием или перемешиванием, можно значительно повысить скорость реакции.