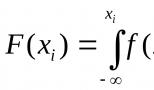Конспект урока по химии: "Электролитическая диссоциация. Водородный показатель. Реакции ионного обмена". Пособие-репетитор по химии Работа 2 электролитическая диссоциация реакции ионного обмена
В ходе урока мы изучим тему «Электролитическая диссоциация. Реакции ионного обмена». Рассмотрим теорию электролитической диссоциации и познакомимся с определением электролитов. Познакомимся с физической и химической теорией растворов. Рассмотрим в свете теории электролитической диссоциации определение оснований, кислот и солей, а также научимся составлять уравнения реакций ионного обмена и узнаем об условиях их необратимости.
Тема: Растворы и их концентрация, дисперсные системы, электролитическая диссоциация
Урок: Электролитическая диссоциация. Реакции ионного обмена
1. Физическая и химическая теория растворов
Еще на заре изучения электрических явлений ученые заметили, что ток могут проводить не только металлы, но и растворы. Но не всякие. Так, водные растворы поваренной соли и других солей, растворы сильных кислот и щелочей хорошо проводят ток. Растворы уксусной кислоты, углекислого и сернистого газа проводят его намного хуже. А вот растворы спирта, сахара и большинства других органических соединений вовсе не проводят электрический ток.
Электрический ток - это направленное движение свободных заряженных частиц . В металлах такое движение осуществляется за счет относительно свободных электронов, электронного газа. Но не только металлы способны проводить электрический ток.
Электролиты - это вещества, растворы или расплавы которых проводят электрический ток.
Неэлектролиты - это вещества, растворы или расплавы которых не проводят электрический ток.
Для описания электропроводности некоторых растворов необходимо понимать, что такое раствор. К концу XIX века существовало 2 основных теории растворов:
· Физическая. Согласно этой теории, раствор - это чисто механическая смесь компонентов, и никакого взаимодействия между частицами в нем нет. Она хорошо описывала свойства электролитов, но имела определенные сложности в описании растворов электролитов.
· Химическая. Согласно этой теории, при растворении происходит химическая реакция между растворяемым веществом и растворителем. Это подтверждается наличием теплового эффекта при растворении, а также изменением цвета. Например, при растворении белого безводного сульфата меди образуется насыщенный синий раствор.
Истина оказалась между двумя этими крайними точками. А именно, в растворах протекает и химический и физический процесс.
Рис. 1. Сванте Аррениус
В 1887 году шведский физико - химик Сванте Аррениус (Рис. 1), исследуя электропроводность водных растворов, высказал предположение, что в таких растворах вещества распадаются на заряженные частицы - ионы, которые могут передвигаться к электродам - отрицательно заряженному катоду и положительно заряженному аноду.
Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод - расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются только переносчиками зарядов в растворе и существуют в нем независимо от того, проходит через раствор ток или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которую часто называют в честь этого ученого. Основная идея данной теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
2. Основные положения теории электролитической диссоциации
1. Электролиты в растворах под действием растворителя самопроизвольно распадаются на ионы. Такой процесс называется электролитической диссоциацией. Диссоциация также может проходить при расплавлении твердых электролитов.
2. Ионы отличаются от атомов по составу и свойствам. В водных растворах ионы находятся в гидратированном состоянии. Ионы в гидратированном состоянии отличаются по свойствам от ионов в газообразном состоянии вещества. Это объясняется так: в ионных соединениях уже изначально присутствуют катионы и анионы. При растворении молекула воды начинает подходить к заряженным ионам: положительным полюсом - к отрицательному иону, отрицательным полюсом - к положительному. Ионы называются гидратированными (рис. 2).
3. В растворах или расплавах электролитов ионы движутся хаотично, но при пропускании электрического тока ионы движутся направленно: катионы - к катоду, анионы - к аноду.
3. Основания, кислоты, соли в свете теории электролитической диссоциации
В свете теории электролитической диссоциации можно дать определении основаниям, кислотам и солям как электролитам.
Основания - это электролиты, в результате диссоциации которых в водных растворах образуется только один вид анионов: гидроксид-анион: OH-.
NaOH ↔ Na+ + OH−
Диссоциация оснований, содержащих несколько гидроксильных групп, происходит ступенчато:
Ba(OH)2↔ Ba(ОН)+ + OH− Первая ступень
Ba(OH)+ ↔ Ba2+ + 2OH− Вторая ступень
Ba(OH)2↔ Ba2+ + 2 OH− Суммарное уравнение
Кислоты - это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов: H+. Ионом водорода называют именно гидратированный протон и обозначают H3O+, но для простоты записывают H+.
HNO3↔ H+ + NO3−
Многоосновные кислоты диссоциируют ступенчато:
H3PO4↔ H+ + H2PO4- Первая ступень
H2PO4- ↔ H+ + HPO42- Вторая ступень
HPO42-↔ H+ + PO43- Третья ступень
H3PO4↔ 3H+ + PO43-Суммарное уравнение
Соли - это электролиты, диссоцирующие в водных растворах на катионы металла и анионы кислотного остатка.
Na2SO4 ↔ 2Na+ + SO42−
Средние соли - это электролиты, диссоциирующие в водных растворах на катионы металла или катионы аммония и анионы кислотного остатка.
Основные соли - это электролиты, диссоциирующие в водных растворах на катионы металла, гидроксид анионы и анионы кислотного остатка.
Кислые соли - это электролиты, диссоциирующие в водных растворах на катионы металла, катионы водорода и анионы кислотного остатка.
Двойные соли - это электролиты, диссоциирующие в водных растворах на катионы нескольких металлов и анионы кислотного остатка.
KAl(SO4)2↔ K+ + Al3+ + 2SO42
Смешанные соли - это электролиты, диссоциирующие в водных растворах на катионы металла и анионы нескольких кислотных остатков
4. Сильные и слабые электролиты
Электролитическая диссоциация в той или иной степени - процесс обратимый. Но при растворении некоторых соединений равновесие диссоциации в значительной степени смещено в сторону диссоциируемой формы. В растворах таких электролитов диссоциация протекает практически необратимо. Поэтому при написании уравнений диссоциации таких веществ пишется или знак равенства или прямая стрелка, обозначающая, что реакция происходит практически необратимо. Такие вещества называют сильными электролитами.
Слабыми называются электролиты, в которых диссоциация происходит незначительно. При написании используют знак обратимости. Табл. 1.
Для количественной оценки силы электролита введено понятие степени электролитической диссоциации .
Силу электролита можно охарактеризовать и при помощи константы химического равновесия диссоциации. Называется она константа диссоциации.
Факторы, влияющие на степень электролитической диссоциации:
· Природа электролита
· Концентрация электролита в растворе
· Температура
При увеличении температуры и разбавлении раствора степень электролитической диссоциации увеличивается. Поэтому оценить силу электролита можно, только сравнивания их при одинаковых условиях. За стандарт принята t = 180С и с = 0,1 моль/л.
5. Реакции ионного обмена
Сущность реакции в растворах электролитов выражается ионным уравнением. В нем учитывается тот факт, что в одном растворе электролиты присутствуют в виде ионов. А слабые электролиты и недиссоциируемые вещества записываются в диссоциируемой на ионы форме. Растворимость электролита в воде нельзя использовать как критерий его силы. Многие нерастворимые в воде соли, являются сильными электролитами, но концентрация ионов в растворе оказывается очень низкой именно вследствие их низкой растворимости. Именно потому при написании уравнений реакций с участием таких веществ их принято записывать в недиссоциированной форме.
Реакции в растворах электролитов протекают в направлении связывания ионов.
Существует несколько форм связывания ионов:
1. Образование осадка
2. Выделение газа
3. Образование слабого электролита.
· 1. Образование осадка:
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl.
Ba2++2Cl - + 2Na++CO32-→ BaCO3↓ + 2Na++2Cl- полное ионное уравнение
Ba2+ + CO32-→ BaCO3↓ сокращенное ионное уравнение.
Сокращенное ионное уравнение показывает, что при взаимодействии любого растворимого соединения, содержащего ион Ba2+, с соединением, содержащим карбонат-анион CO32-, в результате получится нерастворимый осадок BaCO3↓.
· 2. Выделение газа:
Na2CO3 +H2SO4 → Na2SO4 + H2O + CO2&
ЗАНЯТИЕ 9 10-й класс (первый год обучения)
Теория электролитической диссоциации. Реакции ионного обмена План
1. Электролиты и неэлектролиты.
2. Теория электролитической диссоциации (ТЭД) С.А.Аррениуса.
3. Механизм электролитической диссоциации электролитов с ионной и ковалентной полярной связью.
4. Степень диссоциации.
5. Кислоты, основания, амфотерные гидроксиды, соли с точки зрения ТЭД.
6. Значение электролитов для живых организмов.
7. Диссоциация воды. Ионное произведение воды. Водородный показатель. Среды водных растворов электролитов. Индикаторы.
8. Реакции ионного обмена и условия их протекания.
По способности проводить электрический ток в водном растворе или расплаве все вещества можно разделить на электролиты и неэлектролиты.
Электролиты – это вещества, растворы или расплавы которых проводят электрический ток; в электролитах (кислоты, соли, щелочи) имеются ионные или полярные ковалентные связи.
Неэлектролиты – это вещества, растворы или расплавы которых не проводят электрический ток; в молекулах неэлектролитов (органические вещества, газы, вода) связи ковалентные неполярные или малополярные.
Для объяснения электропроводности растворов и расплавов электролитов Аррениус в 1887 г. создалтеорию электролитической диссоциации , основные положения которой звучат следующим образом.
1. Молекулы электролитов в растворе или расплаве подвергаются диссоциации (распадаются на ионы). Процесс распада молекул электролитов на ионы в растворе или расплаве называется электролитической диссоциацией . Ионы – это частицы, имеющие заряд. Положительно заряженные ионы – катионы , отрицательно заряженные – анионы . Свойства ионов отличаются от свойств соответствующих нейтральных атомов, что объясняется разным электронным строением этих частиц.
2. В растворе или расплаве ионы движутся хаотически. Однако при пропускании через раствор или расплав электрического тока движение ионов становится упорядоченным: катионы движутся к катоду (отрицательно заряженному электроду), а анионы – к аноду (положительно заряженному электроду).
3. Диссоциация – обратимый процесс. Одновременно с диссоциацией идет ассоциация – процесс образования молекул из ионов.
4. Общая сумма зарядов катионов в растворе или расплаве равна общей сумме зарядов анионов и противоположна по знаку; раствор в целом электронейтрален.
Главной причиной диссоциации в растворах с полярным растворителем является сольватация ионов (в случае водных растворов – гидратация). Диссоциация ионных соединений в водном растворе протекает полностью (KCl, LiNO 3 , Ba(OH) 2 и др.). Электролиты с полярной ковалентной связью могут диссоциировать частично или полностью в зависимости от величины полярности связи (H 2 SO 4 , HNO 3 , HI и др.). В водном растворе образуются гидратированные ионы, но для простоты записи в уравнениях изображаются ионы без молекул воды:

Одни электролиты диссоциируют полностью, другие – частично. Для характеристики диссоциации вводится понятие степень электролитической диссоциации . Величинапоказывает отношение числа диссоциировавших молекулn к числу растворенных молекул N электролита в растворе:
= n /N .
Степень диссоциации увеличивается при разбавлении раствора и при повышении температуры раствора. В зависимости от степени диссоциации электролиты делятся на сильные, средней силы и слабые. Сильные электролиты практически полностью диссоциируют в растворе, их степень диссоциации больше 30% и стремится к 100%. К средним электролитам относятся электролиты, степень диссоциации которых колеблется в пределах от 3% до 30%. Степень диссоциации слабых электролитов меньше 3%. К сильным электролитам относятся соли, сильные кислоты, щелочи. К слабым – слабые кислоты, нерастворимые основания, гидроксид аммония, вода.
С точки зрения теории электролитической диссоциации можно дать определения веществам разных классов.
Кислоты – это электролиты, образующие при диссоциации катионы водорода и анионы кислотного остатка. Число ступеней диссоциации зависит от основности кислоты, например:
HCl H + + Cl – ,
H 2 CO 3 H + + HCO 3 – 2H + + CO 3 2– .
Основания – это электролиты, диссоциирующие на катионы металла и анионы гидроксигрупп. Число ступеней диссоциации зависит от кислотности основания, например:
NaOH Na + + 2OH – ,
Ca(OH) 2 CaOH + + OH – Ca 2+ + 2OH – .
Амфотерные гидроксиды – это слабые электролиты, которые при диссоциации образуют как катионы водорода, так и анионы гидроксигруппы, например:
Zn(OH) 2 ZnOH + + OH – Zn 2+ + 2OH – ,
H 2 ZnO 2 H + + HZnO 2 – 2H + + ZnO 2 2– .
Средние соли – это электролиты, диссоциирующие на катионы металла и анионы кислотного остатка, например:
Na 2 SO 4 2Na + + SO 4 2– .
Кислые соли – это электролиты, диссоциирующие на катионы металла и сложные анионы, в состав которых входят атомы водорода и кислотный остаток, например:
NaНСO 3 Na + + НСO 3 – .
Основные соли – это электролиты, диссоциирующие на анионы кислотного остатка и сложные катионы, состоящие из атомов металла и гидроксигрупп, например:
Сu(OН)Сl CuОН + + Сl – .
Комплексные соли – это электролиты, образующие при диссоциации сложные комплексные ионы, которые довольно устойчивы в водных растворах, например:
K 3 3K + + 3– .
Электролиты являются составной частью жидкостей и тканей живых организмов. Для нормального протекания физиологических и биохимических процессов необходимы катионы натрия, калия, кальция, магния, водорода, анионы хлора, сульфат-ионы, гидрокарбонат-ионы, гидроксид-ионы и др. Концентрации этих ионов в организме человека различны. Так, например, концентрации ионов натрия и хлора весьма значительны и ежедневно пополняются. Концентрации ионов водорода и гидроксид-ионов очень малы, но играют большую роль в жизненных процессах, способствуя нормальному функционированию ферментов, обмену веществ, перевариванию пищи и т.д.
Диссоциация воды .
Водородный показатель
Вода является слабым амфотерным электролитом. Уравнение диссоциации воды имеет вид:
Н 2 O Н + + ОН –
2Н 2 O Н 3 О + + ОН – .
Концентрация протонов и гидроксид-ионов в воде одинакова и составляет 10 –7 моль/л при 25 °С.
Произведение концентраций ионов водорода и гидроксид-ионов называется ионным произведением воды и при 25 °С составляет 10 –14 .
Среду любого водного раствора можно охарактеризовать концентрацией ионов Н + или ОН – . Различают нейтральную, кислую и щелочную среды растворов.
В нейтральной среде раствора:
10 –7 моль/л,
в кислой среде раствора:
> , т.е. > 10 –7 моль/л,
в щелочной среде раствора:
> , т.е. > 10 –7 моль/л.
Для характеристики среды раствора удобно пользоваться водородным показателем рН (табл. 1, см. с. 14). Водородный показатель – это отрицательный десятичный логарифм концентрации ионов водорода:
рН = –lg.
Урок: Электролитическая диссоциация. Водородный показатель. Реакции ионного обмена
Цели:
систематизировать знания учащихся об электролитической диссоциации. Показать научный подвиг основоположников теории. Показать зависимость свойств веществ от их строения. Привести полученные учащимися знания по теме в единую систему.
Задачи:
Совершенствовать умения и навыки составления уравнений диссоциации, ионных уравнений, уравнений гидролиза. Сформировать умение предсказывать среду растворов различных солей. Систематизировать знания учащихся о гидролизе органических веществ. Развить способность наблюдать, анализировать и делать выводы.
Оборудование и реактивы
: мультимедиапроектор, компьютер.
Ход урока
Актуализация опорных знаний:
Учащиеся дают ответ по плану:
- Что такое электрическая проводимость растворов?
- Электролитическая диссоциация солей, оснований и кислот.
- Механизм электролитической диссоциации веществ с ионной связью.
Подведение к изучению новой темы: - Почему растворы кислот, солей и щелочей проводят электрический ток?
Почему температура кипения раствора электролита всегда будет выше, чем температура кипения раствора не электролита той же концентрации?
Изучение нового материала:
1. Понятие электролитическая диссоциация
В 1887 году шведский физико - химик Сванте Аррениус, исследуя электропроводность водных растворов, высказал предположение, что в таких растворах вещества распадаются на заряженные частицы – ионы, которые могут передвигаться к электродам – отрицательно заряженному катоду и положительно заряженному аноду.
Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются толькопереносчиками зарядов в растворе и существуют в нем независимо от того, проходит черезраствор ток или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которою часто называют в честь этого ученого. Основная идея данной теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
Электрический ток - это направленное движение свободных заряженных частиц. Вы уже знаете, что растворы и расплавы солей и щелочей электропроводны, так как состоят не из нейтральных молекул, а из заряженных частиц – ионов. При расплавлении или растворении ионы становятся свободными переносчиками электрического заряда.
Процесс распада вещества на свободные ионы при его растворении или расплавлении называют электролитической диссоциацией.
2. Сущность процесса электролитической диссоциации солей
Сущность электролитической диссоциации заключается в том, что ионы становятся свободными под влиянием молекулы воды. Рис.1. Процесс распада электролита на ионы отображают с помощью химического уравнения. Запишем уравнение диссоциации хлорида натрия и бромида кальция. При диссоциации одного моля хлорида натрия образуются один моль катионов натрия и один моль хлорид - анионов. NaCl ⇄ Na+ + Cl-
При диссоциации одного моля бромида кальция образуется один моль катионов натрия и два моля бромид - анионов.
CaBr2 ⇄ Ca2+ + 2Br-
Обратите внимание: так как в левой части уравнения записана формула электронейтральной частицы, то суммарный заряд ионов должен быть равен нулю.
Вывод : при диссоциации солей образуются катионы металла и анионы кислотного остатка.
3. Сущность процесса электролитической диссоциации щелочей
Рассмотрим процесс электролитической диссоциации щелочей. Запишем уравнение диссоциации в растворе гидроксида калия и гидроксида бария.
При диссоциации одного моля гидроксида калия образуются один моль катионов калия и один моль гидроксид-анионов. KOH ⇄ K+ + OH-
При диссоциации одного моля гидроксида бария образуются один моль катионов бария и два моля гидроксид - анионов. Ba(OH)2 ⇄ Ba2+ + 2 OH-
Вывод: при электролитической диссоциации щелочей образуются катионы металла и гидроксид - анионы.
Нерастворимые в воде основания практически не подвергаются электролитической диссоциации, так как в воде они практически нерастворимы, а при нагревании – разлагаются, так что расплав их получить не удается.
4. Сущность процесса электролитической диссоциации кислот
Рассмотри процесс электролитической диссоциации кислот. Молекулы кислот образованы ковалентной полярной связью, а значит, кислоты состоят не из ионов, а из молекул.
Возникает вопрос – как же тогда кислота диссоциирует, т. е как в кислотах образуются свободные заряженные частицы? Оказывается, ионы образуются в растворах кислот именно при растворении.
Рассмотрим процесс электролитической диссоциации хлороводорода в воде, но для этого запишем строение молекул хлороводорода и воды. Обе молекулы образованы ковалентной полярной связью. Электронная плотность в молекуле хлороводорода смещена к атому хлора, а в молекуле воды – к атому кислорода. Молекула воды способна оторвать катион водорода от молекулы хлороводорода, при этом образуется катион гидроксония Н3О+.
Тогда уравнение диссоциации хлороводорода выглядит так: HCl ⇄ H+ + Cl-
5. Ступенчатая диссоциация кислот
Ступенчатая диссоциация серной кислоты
Рассмотри процесс электролитической диссоциации серной кислоты. Серная кислота диссоциирует ступенчато, в две стадии.
I–я стадия диссоциации
На первой стадии отрывается один катион водорода и образуется гидросульфат-анион.
H2SO4 ⇄ H+ + HSO4-
гидросульфат-анион.
II - я стадия диссоциации
На второй стадии происходит дальнейшая диссоциация гидросульфат - анионов. HSO4- ⇄ H+ + SO42-
Эта стадия является обратимой, то есть, образующиеся сульфат - ионы могут присоединять к себе катионы водорода и превращаться в гидросульфат - анионы. Это показано знаком обратимости.
Существуют кислоты, которые даже на первой стадии диссоциируют не полностью – такие кислоты являются слабыми. Например, угольная кислота Н2СО3.
Водородный показатель характеризует концентрацию свободных ионов водорода в воде.
Для удобства отображения был введен специальный показатель, названный рН и представляющий собой логарифм концентрации ионов водорода, взятый с обратным знаком, т.е. pH = -log.
Если говорить проще, то величина рН определяется количественным соотношением в воде ионов Н + и ОН - , образующихся при диссоциации воды. Если в воде пониженное содержание свободных ионов водорода (рН>7) по сравнению с ионами ОН - , то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н + (рН<7)- кислую. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В таких случаях вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН.
Рефлексия: составить синквейн
Д/З:
Подведение итога урока
На этом уроке вы узнали, что растворы кислот, солей и щелочей электропроводны, так как при их растворении образуются заряженные частицы – ионы. Такой процесс называется электролитической диссоциацией. При диссоциации солей образуются катионы металла и анионы кислотных остатков. При диссоциации щелочей образуются катионы металла и гидроксид-анионы. При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
Еще на заре изучения электрических явлений ученые заметили, что ток могут проводить не только металлы, но и растворы. Но не всякие. Так, водные растворы поваренной соли и других солей, растворы сильных кислот и щелочей хорошо проводят ток. Растворы уксусной кислоты, углекислого и сернистого газа проводят его намного хуже. А вот растворы спирта, сахара и большинства других органических соединений вовсе не проводят электрический ток.
Электрический ток - это направленное движение свободных заряженных частиц . В металлах такое движение осуществляется за счет относительно свободных электронов, электронного газа. Но не только металлы способны проводить электрический ток.
Электролиты - это вещества, растворы или расплавы которых проводят электрический ток.
Неэлектролиты - это вещества, растворы или расплавы которых не проводят электрический ток.
Для описания электропроводности некоторых растворов необходимо понимать, что такое раствор. К концу XIX века существовало 2 основных теории растворов
· Физическая . Согласно этой теории раствор-это чисто механическая смесь компонентов и никакого взаимодействия между частицами в нем нет. Она хорошо описывала свойства электролитов, но имела определенные сложности в описании растворов электролитов.
· Химическая . Согласно этой теории при растворении происходит химическая реакция между растворяемым веществом и растворителем. Это подтверждается наличием теплового эффекта при растворении, также изменением цвета. Например, при растворении белого безводного сульфата меди, образуется насыщенный синий раствор.
Истина оказалась между двумя этими крайними точками. А именно, в растворах протекает и химический и физический процесс .
В 1887 году шведский физико - химик Сванте Аррениус, исследуя электропроводность водных растворов, высказал предположение, что в таких растворах вещества распадаются на заряженные частицы – ионы, которые могут передвигаться к электродам – отрицательно заряженному катоду и положительно заряженному аноду.
Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются только переносчиками зарядов в растворе и существуют в нем независимо от того, проходит через раствор ток или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которою часто называют в честь этого ученого. Основная идея данной теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
1. Электролиты в растворах под действием растворителя самопроизвольно распадаются на ионы. Такой процесс называется электролитической диссоциацией. Диссоциация также может проходить при расплавлении твердых электролитов.
2. Ионы отличаются от атомов по составу и свойствам. В водных растворах ионы находятся в гидратированном состоянии. Ионы в гидратированном состоянии отличаются по свойствам от ионов в газообразном состоянии вещества. Это объясняется так: ионных соединениях уже изначально присутствуют катионы и анионы. При растворении, молекула воды начинает подходить к заряженным ионам - положительным полюсом к отрицательному иону, отрицательным полюсом - к положительному. Ионы называются гидратированными.
3. В растворах или расплавах электролитов ионы движутся хаотично, но при пропускании электрического тока ионы движутся направленно: катионы – к катоду, анионы - к аноду.
В свете теории электролитической диссоциации, можно дать определении основаниям, кислотам и солям как электролитам.
Основания – это электролиты, в результате диссоциации которых в водных растворах, образуется только один вид анионов: гидроксид-анион: OH -
NaOH ↔ Na + + OH −
Диссоциация оснований, содержащих несколько гидроксильных групп, происходит ступенчато.
Ba(OH) 2 ↔ Ba(ОН) + + OH − Первая ступень
Ba(OH) + ↔ Ba 2+ + 2OH − Вторая ступень
Ba(OH) 2 ↔ Ba 2+ + 2 OH − Суммарное уравнение
Кислоты - это электролиты, в результате диссоциации которых в водных растворах, образуется только один вид катионов:H + , Ионом водорода называют именно гидратированный протон и обозначают H 3 O + , но для простоты записывают H +
HNO 3 ↔ H + + NO 3 −
Многоосновные кислоты диссоциируют ступенчато
H 3 PO 4 ↔ H + + H 2 PO 4 - Первая ступень:
H 2 PO 4 - ↔ H + + HPO 4 2- Вторая ступень:
HPO 4 2- ↔ H + + PO 4 3- Третья ступень:
H 3 PO 4 ↔ 3H + + PO 4 3- Суммарное уравнение
Соли
- это электролиты, дислоцирующие в водных растворах на катионы металла и анионы кислотного остатка.
Na 2 SO 4 ↔ 2Na + + SO 4 2−
Средние соли это электролиты, диссоциирующие в водных растворах на катионы металла или катионы аммония, и анионы кислотного остатка.
Основные соли - это электролиты, диссоциирующие в водных растворах на катионы металла, гидроксид анионы и анионы кислотного остатка.
Кислые соли это электролиты, диссоциирующие в водных растворах на катионы металла, катионы водорода и анионы кислотного остатка.
Двойные соли - это электролиты, диссоциирующие в водных растворах на катионы нескольких металлов и анионы кислотного остатка.
KAl (SO 4) 2 ↔ K + + Al 3+ + 2SO 4 2
Смешенные соли - это электролиты, диссоциирующие в водных растворах на катионы металла и анионы нескольких кислотных остатков
Электролитическая диссоциация в той или иной степени процесс обратимый. Но при растворении некоторых соединений равновесие диссоциации в значительной степени смещено в сторону диссоциируемой формы. В растворах таких электролитов диссоциация протекает практически необратимо. Поэтому при написании уравнений диссоциации таких веществ пишется или знак равенства или прямую стрелку, обозначающую, что реакция происходит практически необратимо. Такие вещества называют сильными электролитами.
Слабыми называются электролиты, в которых диссоциация происходит незначительно. При написании используют знак обратимости.Таб.1.
Для количественной оценки силы электролита введено понятие степени электролитической диссоциации .
Силу электролита можно охарактеризовать и при помощи константы химического равновесия диссоциации. Называется константа диссоциации.
Факторы, влияющие на степень электролитической диссоциации:
· Природа электролита
· Концентрация электролита в растворе
· Температура
При увеличении температуры и разбавлении раствора, степень электролитической диссоциации увеличивается. Поэтому оценить силу электролита можно только сравнивания их при одинаковых условиях. За стандарт принята t=18 0 С и с=0,1 моль/л.
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ | СЛАБЫЕ ЭЛЕКТРОЛИТЫ |
Степень диссоциации при 18 0 С в растворах с концентрацией электролита 0,1 моль/л близка к 100%.диссоциируют практически необратимо. | Степень диссоциации при 18 0 С в растворах с концентрацией электролита 0,1 моль/л значительно меньше 100%.Диссоцииация необратима. |
· Некоторые неорганические кислоты (НNO 3 , HClO 4 ,HI, HCl, HBr, H 2 SO 4) | · Гидроксиды металлов, кроме IA и IIAгрупп, раствор аммиака · Многие неорганические кислоты (H 2 S, HCN, HClO, HNO 2) · Органические кислоты (HCOOH, CH 3 COOH) |
Сущность реакции в растворах электролитов выражается ионным уравнением. В нем учитывается тот факт, что в одном растворе электролиты присутствуют в виде ионов. А слабые электролиты и недиссоциируемые вещества записываются в диссоциируемой на ионы форме. Растворимость электролита в воде нельзя использовать как критерий его силы. Многие нерастворимые в воде соли, являются сильными электролитами, но концентрация ионов в растворе оказывается очень низкой именно вследствие их низкой растворимости. Именно потому при написании уравнений реакций с участием таких веществ их принято записывать в недиссоциированной форме.
Реакции в растворах электролитов протекают в направлении связывания ионов.
Существует несколько форм связывания ионов.
1. Образование осадка
2. Выделение газа
3. Образование слабого электролита.
· 1. Образование осадка:
BaCl 2 + Na 2 CO 3 → BaCO 3 ↓ + 2NaCl.
Ba 2+ +2Cl - + 2Na + + CO 3 2- →BaCO 3 ↓ + 2Na + +2Cl - полное ионное уравнение
Ba 2+ + CO 3 2- → BaCO 3 ↓ сокращенное ионное уравнение.
Сокращенное ионное уравнение показывает, что при взаимодействии любого растворимого соединения, содержащего ион Ba 2+ с соединением, содержащим карбонат анион CO 3 2 , - в результате получится нерастворимый осадок BaCO 3 ↓.
· 2. Выделение газа.
Na 2 CO 3 +H 2 SO 4 → Na 2 SO 4 + H 2 O + CO 2
2Na + + CO 3 2- +2H + + SO 4 2 - → 2Na + + SO 4 2 - + H 2 O + CO 2 полное ионное уравнение
2H + + CO 3 2- → H 2 O + CO 2 сокращенное ионное уравнение.
· 3. Образование слабого электролита
KOH + HBr → KBr + H 2 O
K + + OH - + H + + Br - → K + + Br - + H 2 O полное ионное уравнение
OH - + H + → H 2 O сокращенное ионное уравнение.
Рассматривая эти примеры, мы убедились, что все реакции в растворах электролитов происходят в направлении связывания ионов.
Цель работы. Приобрести навыки составления молекулярных и ион- ных уравнений реакций, протекающих в растворах электролитов. Нау- читься определять направление протекания ионных реакций.
При растворении некоторых веществ в воде (или других поляр- ных растворителях) под воздействием молекул растворителя проис- ходит распад молекул данного вещества на ионы. В результате этого процесса раствор содержит не только молекулы растворителя и рас- творенного вещества, но и образовавшиеся ионы. Растворы веществ, которые при растворении в воде или других полярных растворителях распадаются на ионы, называются электролитами.
Процесс распада молекул растворенного вещества (электроли- та) на ионы под действием полярных молекул растворителя называ- ется электролитической диссоциацией.
Растворы электролитов обладают ионной электропроводностью (в переносе электрических зарядов участвуют ионы) и являются про- водниками второго рода.
Количественной характеристикой процесса распада растворенно- го вещества на ионы является степень электролитической диссоциа- ции – α. Степенью диссоциации называется отношение числа молекул растворенного вещества, распавшихся на ионы в растворе (n), к об- щему числу растворенных молекул (N):
Степень электролитической диссоциации определяется опытным пу- тем и выражается либо в долях единицы, либо в процентах. Степень дис- социации электролита зависит от природы электролита, концентрации и температуры.
По степени диссоциации электролита в растворе с молярной кон-
центрацией эквивалента, равной 0,1 моль/л (0,1 н.), растворы условно
делят на три группы: сильные, слабые и средние электролиты. Если в
0,1 н. растворе электролита α > 0,3 (30 \%) электролит считается сильным, α ≤ 0,03 (3 \%) – слабым электролитом. Электролиты с промежуточными значениями степени диссоциации считают средними.
К сильным электролитам, если растворителем является вода, отно-
– кислоты: НNO3, H2SO4, НCNS, НCl, НClO3, HClO4, HBr, HВrО3, HВrО4, НI, НIO3 HMnO4, H2SeO4, HReO4, HTcO4; а также кислоты Н2СrO4, H4P2O7, H2S2O6 которые являются сильными по первой ступени дис- социации, т. е. при отрыве первого иона Н+;
– основания: гидроксиды щелочных (Li, Na, K, Rb, Cs, Fr) и щелочнозе- мельных металлов (Ca, Sr, Ba, Ra): LiOH, NаОН, KОH, RbОН, CsОН, FrОН, Ca(OH)2, Ba(OH)2, Sr(OH)2; Ra(OH)2; а также TlOH;
– большинство солей. Исключение: Fe(SCN)3, Mg(CN)2, HgCl2, Hg(CN)2.
К слабым электролитам относятся:
– кислоты: H2CO3, НClO, H2S, H3BO3, HCN, H2SO3, H2SiO3, CH3COOH, HCOOH, H2C2O4 и т. д. (Приложение, табл. 2);
– основания (р- и d-элементов): Be(OH)2, Mg(OH)2, Fe(OH)2, Zn(OH)2; гид- роксид аммония NH4OH, а также органические основания – амины (CH3NH2) и амфолиты (H3N+CH2COOˉ).
Вода является очень слабым электролитом (H2O) α = 2·10-9, т. е.
молекулы воды также могут распадаться на ионы за счет взаимодействия молекул между собой.
Сильные электролиты – вещества, которые при растворении в воде полностью распадаются на ионы, т. е. диссоциируют практически нацело. После разрыва связи между ионами в молекуле электролита под действи- ем молекул воды, образовавшиеся ионы окружают себя молекулами воды и поэтому в растворе находятся в гидратированном состоянии. С учетом гидратации ионов уравнение электролитической диссоциации можно бы- ло бы записать таким образом:
|
|
Уравнение диссоциации сильного электролита записывают упрощенно,
например:
NaCl → Na+ + Clˉ;
HNO3 → H+ + NO3ˉ;
Ва(ОН)2 → Ва2+ + 2ОНˉ
К слабым электролитам относятся вещества, которые при растворе- нии в воде частично диссоциируют на ионы. Между ионами, концентра- ция которых в растворе невелика, и реально существующими недиссоции- рованными молекулами устанавливается равновесие:
CH3COOH ⇄ CH3COOˉ + H+; H2О ⇄ H+ + ОНˉ.
Такая запись означает, что в растворе одновременно происходят два
процесса: распад молекул на ионы и образование молекул из ионов. Рав- новесие в растворах слабых электролитов смещено в сторону исходных продуктов, поэтому слабые электролиты в растворе существуют преиму- щественно в виде молекул.
Химические свойства растворов электролитов зависят от свойств ио- нов и молекул, находящихся в растворе. Направление протекания реакций между ионами и молекулами в растворах электролитов определяется воз- можностью образования малорастворимых веществ или слабых электро- литов. Если в результате реакции не происходит образования малорас- творимого вещества или слабого электролита, то такая реакция протекать не может. Например, при сливании растворов нитрата натрия и хлорида калия реакция не протекает, так как по обменной реакции из ионов нахо- дящихся в растворе не может образоваться какое либо малорастворимое вещество или слабый электролит. Эти соли относятся к сильным электро- литам и хорошо растворяются в воде, поэтому в растворе будет находить-
ся смесь ионов:
Na+ + NO3ˉ + K+ + Clˉ,
из которых состояли исходные вещества. Следовательно, в этом случае нельзя написать молекулярное уравнение обменной реакции
NaNO3 + KCl ≠ KNO3 + NaCl.
Реакцию, протекающую в растворе, можно представить в виде:
Молекулярного уравнения реакции;
Ионно-молекулярного уравнения (полного или сокращенного).
Уравнение реакции, содержащее только формулы недиссоциирован- ных веществ, называется молекулярным уравнением. Молекулярная форма уравнения показывает, какие вещества и в каком количестве участвуют в реакции. Оно позволяет производить необходимые расчеты, связанные с данной реакцией. Уравнение, содержащее формулы недиссоциированных слабых электролитов и ионы сильных электролитов, называется полным ионным или ионно-молекулярным уравнением реакции.
Сократив одинаковые продукты в левой и правой части ионно- молекулярного уравнения реакции, получаем сокращенное или краткое ионное уравнение реакции. Ионное уравнение, не содержащее одинако- вых веществ (ионов или молекул) в левой и правой части реакции, назы- вается сокращенным или кратким ионным уравнением реакции. Это урав- нение и отражает сущность происходящей реакции.
При записи ионных уравнений реакций необходимо помнить:
1) сильные электролиты следует записывать в виде отдельных со-
ставляющих их ионов;
2) слабые электролиты и малорастворимые вещества следует запи-
сывать в виде молекул.
В качестве примера рассмотрим взаимодействие соды с кислотой. В молекулярном уравнении реакции исходные вещества и продукты реак- ции записывают в виде молекул:
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O.
Принимая во внимание, что в водном растворе молекулы электроли-
тов распадаются на ионы, полное ионное уравнение этой реакции имеет вид
CO 2–В ионном уравнении слабые электролиты, газы и малорастворимые вещества записывают в виде молекул. Знак ↓, стоящий при формуле веще- ства, обозначает, что это вещество выведено из сферы реакции в виде
осадка, а знак обозначает, что вещество удаляется из сферы реакции в виде газа.
Вещества, молекулы которых полностью диссоциируют на ионы (сильные электролиты), записывают в виде ионов. Сумма электрических зарядов левой части уравнения должна быть равна сумме электрических зарядов правой части.
При написании ионных уравнений следует руководствоваться табли- цей растворимости кислот, оснований и солей в воде, т. е. обязательно проверять растворимость реагентов и продуктов, отмечая это в уравнени- ях, а также таблицей констант диссоциации слабых электролитов (Прило- жение, табл. 1 и 2). Рассмотрим примеры записи некоторых ионно- молекулярных уравнений.
Пример 1. Образование трудно- и малорастворимых соединений (осадка).
а) Образование сульфата бария
Молекулярное уравнение реакции:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl.
Полное ионное (ионно-молекулярное) уравнение реакции:
Ba2+ + 2Clˉ + 2Na+ + SO4 ˉ = BaSO4↓ + 2Na
CO 2–CO2 + H2O (сокращенное ионное уравнение).
Пример 3. Образование слабого электролита.
2Na+ + 2OH– +2H+ + SO 2–(полное ионное уравнение)
2OH– + 2H+ = 2H2O (сокращенное ионное уравнение).
Реакция нейтрализации сильной кислоты сильным основанием сводится к взаимодействию ионов водорода с гидроксид-ионами;
б) слабой кислоты:
2NaNO2 + H2SO4 = 2HNO2 + Na2SO4 (молекулярное уравнение)
NH +(полное ионное уравнение)
NH4OH (сокращенное ионное уравнение).
Сильные основания вытесняют слабые основания из их солей.
Пример 4. Когда среди исходных соединений и продуктов реакции есть слабый электролит или малорастворимое вещество, то в уравнении применяет-
ся знак равновесия «⇄». Равновесие в реакции смещается в сторону более слабого электролита или малорастворимого вещества, что обозначается
значком (↷)..
а) CH3COOH + NaОН ⇄ CH3COONa + H2O
CH3COOН + ОНˉ ⇄ CH3COOˉ + H2O (↷).
В результате реакции образуется более слабый электролит – вода. Равнове-
сие смещается в сторону прямой реакции.
б) CaSO4↓ + Na2CO3 ⇄ CaCO3↓ + Na2SO4;
|
|
⇄ CaCO3↓ + 2 Na+
В результате реакции образуется менее растворимая соль – карбонат каль-
ция. Равновесие смещается в сторону прямой реакции.
Пример 5. Составьте три возможных молекулярных уравнения реакции,
соответствующих сокращенному ионному уравнению: CH3COO– + H+ = CH3COOH.
Решение. В левой части ионного уравнения указаны свободные ионы СН3СОО– и Н+. Эти ионы образуются при диссоциации каких-либо раствори- мых сильных электролитов. Ионы СН3СОО– могут образовываться при диссо- циации, например солей КСН3СОО, NaCH3COO, Mg (CH3COO)2; донорами ио-
нов Н+ могут быть любые сильные кислоты. Молекулярные уравнения реакций,
которым отвечает данное молекулярно-ионное уравнение, могут быть:
1. KCH3COO + HCl = CH3COOH + KCl;
2. NaCH3COO + HNO3 = CH3COOH + NaNO3;
3. Mg(CH3COO)2 + H2SO4 = 2 CH3COOH + MgSO4.
Техника безопасности
1. Соблюдайте особую осторожность при работе с растворами кислот и щелочей, не допускайте их попадания на кожу и одежду.
2. Если в процессе эксперимента выделяется токсичный газообразный продукт, то обязательно проводите опыт в вытяжном шкафу при работаю- щей вентиляции.
3. Соблюдайте осторожность при работе с токсичными солями и их растворами (соли бария, хрома, меди и др.).