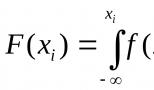Метод титрования в химии. Титриметрический анализ. Специфика титриметрического исследования
Титриметрический анализ – метод определения количества вещества путем точного измерения объема растворов веществ, вступающих между собой в реакцию.
Титр – количество г. вещества содержащегося в 1 мл. раствора или эквивалентное определяемому веществу. Например, если титр H 2 SO 4 равен 0,0049 г/мл, это значит, что каждый мл раствора содержит 0,0049 г. серной кислоты.
Раствор, титр которого известен, называется титрованным. Титрование – процесс добавления к исследуемому раствору или его аликвотной части эквивалентного количества титрованного раствора. При этом используются стандартные растворы – фиксаналы – растворы с точной концентрацией вещества (Na 2 CO 3 , HCl).
Реакция титрования должна отвечать следующим требованиям:
высокая скорость реакции;
реакция должна протекать до конца;
реакция должна быть высоко стехиометричной;
иметь удобный метод фиксирования конца реакции.
HCl + NaOH → NaCl + H 2 O
Главная задача титриметрического анализа – не только использовать раствор точно известной концентрации (фиксанал), но и правильно определить точку эквивалентности.
Существует несколько способов зафиксировать точку эквивалентности:
По собственной окраске ионов определяемого элемента, например марганца в виде аниона MnO 4 -
По веществу-свидетелю
Пример: Ag + + Cl - " AgCl $
Ag + + CrO 4 " Ag 2 CrO 4 $ (ярко оранжевая окраска)
В колбу, где требуется определить ион хлора, добавляют небольшое количество соли K 2 CrO 4 (свидетель). Затем из бюретки постепенно добавляют исследуемое вещество, при этом первыми в реакцию вступают ионы хлора и образуется белый осадок (AgCl), т. е. ПР AgCl << ПР Ag2Cr O4.
Таким образом, лишняя капля нитрата серебра даст ярко оранжевую окраску, т. к. весь хлор уже прореагировал.
III . С помощью индикаторов : например, при реакции нейтрализации используют кислотно-щелочные индикаторы: лакмус, фенолфталеин, метил оранж – органические соединения изменяющие окраску при переходе от кислой к щелочной среде.
Индикаторы – органические красители, которые меняют свою окраску при изменении кислотности среды.
Схематически (опуская промежуточные формы) равновесие индикатора можно представить как кислотно-основную реакцию
HIn +H 2 O In - + H 3 O +
H 2 O
 H +
+ OH -
H +
+ OH -
H +
+ H 2 O
 H 3 O +
H 3 O +
На область перехода окраски индикатора (положение и интервал) влияют все факторы, от которых зависит константа равновесия (ионная сила, температура, посторонние вещества, растворитель), а также индикатора.
Классификация методов титриметрического анализа.
кислотно-основное титрование (нейтрализация): этим методом определяют количество кислоты или щёлочи в анализируемом растворе;
осаждение и комплексообразование (аргентометрия)
Ag + + Cl - " AgCl $
окислительно-восстановительное титрование (редоксиметрия):
а) перманганатометрия (KMnO 4);
б) йодометрия (Y 2);
в) броматометрия (KBrO 3);
г) дихроматометрия (K 2 Cr 2 O 7);
д) цериметрия (Ce(SO 4) 2);
е) ванадометрия (NH 4 VO 3);
ж) титанометрия (TiCl 3) и т.д.
Титриметрический анализ (объемный анализ) -- метод количественного анализа, основанный на измерении объема или массы реагента, требующегося для реакции с исследуемым веществом. Титриметрический анализ широко применяется в биохимических, клинических, санитарно-гигиенических и других лабораториях в экспериментальных исследованиях и для клинических анализов. Например, при установлении кислотно-щелочного равновесия, определении кислотности желудочного сока, кислотности и щелочности мочи и др. Титриметрический анализ служит также одним из основных методов химического анализа в контрольно-аналитических аптечных лабораториях.
Количество исследуемого вещества при титриметрическом анализе определяют путем титрования: к точно отмеренному объему раствора исследуемого вещества постепенно приливают раствор другого вещества известной концентрации до тех пор, пока его количество не станет химически эквивалентным количеству исследуемого вещества. Состояние эквивалентности называется точкой эквивалентности титрования. Применяемый для титрования раствор реактива известной концентрации называют титрованным раствором (стандартным раствором или титрантом): точная концентрация титрованного раствора может быть выражена титром (г/мл), нормальностью (экв/л) и др.
К реакциям, используемым при титриметрическом анализе, предъявляются следующие требования: вещества должны реагировать в строго количественных (стехиометрических) отношениях без побочных реакций, реакции должны протекать быстро и практически до конца; для установления точки эквивалентности необходимо применять достаточно надежные способы, влияние посторонних веществ на ход реакции должно быть исключено. Кроме того, желательно, чтобы при титриметрическом анализе реакции протекали при комнатной температуре.
Точку эквивалентности в титриметрическом анализе определяют по изменению окраски титруемого раствора или индикатора, вводимого в начале или в процессе титрования, изменению электропроводности раствора, изменению потенциала электрода, погруженного в титруемый раствор, изменению величины тока, оптической плотности и др.
Одним из широко применяемых способов фиксации точки эквивалентности является индикаторный метод. Индикаторы -- вещества, которые дают возможность установить конечную точку титрования (момент резкого изменения окраски титруемого раствора). Наиболее часто индикатор добавляют ко всему титруемому раствору (внутренний индикатор). При работе с внешними индикаторами периодически берут каплю титруемого раствора и смешивают с каплей раствора индикатора или помещают на индикаторную бумагу (что приводит к потерям анализируемого вещества).
Процесс титрования изображают графически в виде кривых титрования, которые позволяют наглядно представить весь ход титрования и выбрать индикатор, наиболее пригодный для получения точных результатов, т.к. кривую титрования можно сопоставить с интервалом изменения окраски индикатора.
Ошибки в титриметрическом анализе могут быть методическими и специфическими, обусловленными особенностями данной реакции. Методические ошибки связаны с особенностями метода титрования и зависят от погрешностей измерительных приборов, калибровки мерной посуды, пипеток, бюреток, неполного отекания жидкостей по стенкам мерной посуды.
Специфические ошибки обусловлены особенностями данной реакции и зависят от константы равновесия реакции и от точности обнаружения точки эквивалентности. фармацевтический лекарство молекула анальгин
Методы титриметрического анализа в зависимости от реакций, лежащих в их основе, подразделяются на следующие основные группы:
- 1. Методы нейтрализации, или кислотно-основного титрования, основаны на реакциях нейтрализации, т. е. на взаимодействии кислот и оснований. Эти методы включают ацидиметрию (количественное определение оснований с помощью титрованных растворов кислот), алкалиметрию (определение кислот с помощью титрованных растворов оснований), галометрию (количественное определение солей с помощью оснований или кислот, если они реагируют с солями в стехиометрических соотношениях).
- 2. Методы осаждения основаны на титровании веществ, образующих в определенной среде нерастворимые соединения, например, соли бария, серебра, свинца, цинка, кадмия, ртути (II), меди (III) и др. К этим методам относят аргентометрию (титрование раствором нитрата серебра), меркурометрию (титрование раствором нитрата закисной ртути) и др.
- 3. Методы комплексообразования, или комплексометрия (меркуриметрия, фторометрия и др.), основаны на применении реакций, при которых образуются комплексные соединения, например Ag+ + 2CN- Ы Ag (CN)2]. Методы комплексообразования тесно связаны с методами осаждения, т.к. многие реакции осаждения сопровождаются комплексообразованием, а образование комплексов -- выпадением в осадок малорастворимых соединений.
- 4. Методы окисления -- восстановления, или оксидиметрия, включают перманганатометрию, хроматометрию (бихроматометрию), йодометрию, броматометрию, цериметрию, ванадометрию и др.
Титриметрический анализ основан на точном измерении количества реактива, израсходованного на реакцию с определяемым веществом. Еще недавно этот вид анализа обычно называли объемным в связи с тем, что наиболее распространенным в практике способом измерения количества реактива являлось измерение объема раствора, израсходованного на реакцию. Сейчас под объемным анализом понимают совокупность методов, основанных на измерении объема жидкой, газовой или твердой фаз.
Название титриметрический связаго со словом титр, обозначающим концентрацию раствора. Титр показывает число граммов растворенного вещества в 1 мл раствора.
Титрованный, или стандартный, раствор - раствор, концентрация которого известна с высокой точностью. Титрование - прибавление титрованного раствора к анализируемому для определения точно эквивалентного количества. Титрующий раствор часто называют рабочим раствором или титрантом. Например, если кислота титруется щелочью, раствор щелочи называется титрантом. Момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества, называется точкой эквивалентности.
Реакции, применяемые в титриметрии, должны удовлетворять следующим основным требованиям:
1) реакция должна протекать количественно, т.е. константа равновесия реакции должна быть достаточно велика;
2) реакция должна протекать с большой скоростью;
3) реакция не должна осложняться протеканием побочных реакций;
4) должен существовать способ определения окончания реакции.
Если реакция не удовлетворяет хотя бы одному из этих требований, она не может быть использована в титриметрическом анализе.
В титриметрии различают прямое, обратное и косвенное титрование.
В методах прямого титрования определяемое вещество непосредственно реагирует с титрантом. Для проведения анализа этим методом достаточно одного рабочего раствора.
В методах обратного титрования (или, как их еще называют, методах титрования по остатку) используются два титрованных рабочих раствора: основной и вспомогательный. Широко известно, например, обратное титрование хлорид-иона в кислых растворах. К анализируемому раствору хлорида сначала добавляют заведомый избыток титрованного раствора нитрата серебра (основного рабочего раствора). При этом происходит реакция образования малорастворимого хлорида серебра.
Не вступившее в реакцию избыточное количество вещества AgNO 3 оттитровывают раствором тиоцианата аммония (вспомогательного рабочего раствора).
Третьим основным видом титриметрических определений является титрование заместителя, или титрование по замещению (косвенное титрование). В этом методе к определяемому веществу добавляют специальный реагент, вступающий с ним в реакцию. Один из продуктов взаимодействия затем оттитровывают рабочим раствором. Например, при иодометрическом определении меди к анализируемому раствору добавляют заведомый избыток KI. Происходит реакция 2Cu 2+ +4I - =2CuI+ I 2 . Выделившийся иод оттитровывают тиосульфатом натрия.
Существует еще так называемое реверсивное титрование, при котором стандартный раствор реагента титруют анализируемым раствором.
Расчет результатов титриметрического анализа основан на принципе эквивалентности, в соответствии с которым вещества реагируют между собой в эквивалентных количествах.
Во избежание каких-либо противоречий рекомендуется все реакции кислотно-основного взаимодействия привести к единой общей основе, которой может быть ион водорода. В окислительно-восстановительных реакциях количество реагирующего вещества удобно связать с числом электронов, принимаемых или отдаваемых веществом в данной полуреакции. Это позволяет дать следующее определение.
Эквивалентом называется некая реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образцом эквивалента одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
При использовании термина «эквивалент» всегда необходимо указывать, к какой конкретной реакции он относится. Эквивалент данного вещества являются не постоянными величинами, а зависят от стехиометрии реакции, в которой они принимают участие.
В титриметрическом анализе используют реакции различного типа: - кислотно-основного взаимодействия, комплексообразования и т.д., удовлетворяющие тем требованиям, которые предъявляются к титриметрическим реакциям. Тип реакции, протекающей при титровании положен в основу классификации титриметрических методов анализа. Обычно выделяют следующие методы титриметрического анализа.
1. Методы кислотно-основного взаимодействия связаны с процессом передачи протона:
2. Методы комплексообразования используют реакции образования координационных соединений:
3. Методы осаждения основаны на реакциях образования малорастворимых соединений:
4. Методы окисления - восстановления объединяют многочисленную группу окислительно-восстановительных реакций:
Отдельные титриметрические методы получили название по типу основной реакции, протекающей при титровании или по названию титранта (например, в аргентометрических методах титрантом является раствор AgNO 3 , в перманганатометрических - раствор КМп0 4 и т.д.).
Методы титрования характеризуются высокой точностью: погрешность определений составляет 0,1 - 0,3%. Рабочие растворы устойчивы. Для индикации точки эквивалентности имеется набор разнообразных индикаторов. Среди титриметрических методов, основанных на реакциях комплексообразования, наибольшее значение имеют реакции с применением комплексонов. Устойчивые координационные соединения с комплексонами образуют почти все катионы, поэтому методы комплексонометрии универсальны и применимы к анализу широкого круга разнообразных объектов.
Метод кислотно-основного титрования основан на реакциях взаимодействия между кислотами и основаниями, то есть на реакции нейтрализации:
Н + + ОН - ↔ Н 2 О
Рабочими растворами метода являются растворы сильных кислот (HCl, H 2 S, НNОз и др.) или сильных оснований (NaOH, КОН, Ва(ОН) 2 и др.). В зависимости от титранта метод кислотно-основного титрования подразделяют на ацидиметрию , если титрантом является раствор кислоты, и алкалиметрию , если титрантом является раствор основания.
Рабочие растворы в основном готовят как вторичные стандартные растворы, поскольку исходные для их приготовления вещества не являются стандaртными, а затем их стандартизуют по стандартным веществам или стандартным растворам. Например: растворы кислот можно стандартизовать по стандартным веществам - натрия тетраборату Na 2 B 4 О 7 ∙10Н 2 О, натрия карбонату Nа 2 СО 3 ∙10Н 2 О или по стандартным растворам NaOH, КОН; а растворы оснований - по щавелевой кислоте Н 2 С 2 О 4 ∙Н 2 О, янтарной кислоте Н 2 С 4 Н 4 О 4 или по стандартным растворам HCl, H 2 SO 4 , НNО 3 .
Точка эквивалентности и конечная точка титрования . Согласно правилу эквивалентности титрование необходимо продолжать до тех пор, пока количество прибавленного реагента не станет эквивалентным содержанию определяемого вещества. Наступающий в процессе титрования момент, когда количecтвo стандартного раствора реагента (титранта) становится теоретически строго эквивалентным количеству определяемого вещества согласно определенному уравнению химической реакции, называют точкой эквивалентности .
Точку эквивалентности устанавливают различными способами, например по изменению окраски индикатора, прибавляемого в титруемый раствор. Момент, при котором происходит наблюдаемое изменение цвета индикатора, называют конечной точкой титрования . Очень часто конечная точка титрования не совсем совпадает с точкой эквивалентности. Как правило, они отличаются друг от друга не более чем на 0,02-0,04 мл (1-2 капли) титранта. Это то количество титранта, которое необходимо для взаимодейcтвия с индикатором.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
План
1. Сущность осадительного титрования
2. Аргентометрическое титрование
3. Тиоцианатометрическое титрование
4. Применение осадительного титрования
4.1 Приготовление стандартизированного раствора нитрата серебра
4.2 Приготовление стандартизированного раствора тиоцианата аммония
4.3 Определение содержания хлора в образце по Фольгарду
4.4 Определение содержания трихлорацетата натрия в техническом препарате
1. Сущность осадительного титрования
Метод объединяет титриметрические определения, основанные на реакциях образования осадков малорастворимых соединений. В этих целях пригодны только некоторые реакции, удовлетворяющие определенным условиям. Реакция должна протекать строго по уравнению и без побочных процессов. Образующийся осадок должен быть практически нерастворимым и выпадать достаточно-быстро, без образования пересыщенных растворов. К тому же необходимо иметь возможность определять конечную точку титрования с помощью индикатора. Наконец, явления адсорбции (соосаждения) должны быть выражены при титровании настолько слабо, чтобы результат определения не искажался.
Наименования отдельных методов осаждения происходят от названий применяемых растворов. Метод, использующий раствор нитрата серебра, называют аргентометрией. Этим методом определяют содержание ионов С1~ и Вг~ в нейтральных или слабощелочных средах. Тиоцианатометрия основана на применении раствора тиоцианата аммония NH 4 SCN (или калия KSCN) и служит для определения следов С1- и Вг~, но уже в сильнощелочных и кислых растворах. Используют ее и для определения содержания серебра в рудах или сплавах.
Дорогостоящий аргентометрический метод определения галогенов постепенно вытесняется меркурометрическим. В последнем используют раствор нитрата ртути (I) Hg 2 (NO 3) 2 .
Рассмотрим более подробно аргентометрическое и тиоцианатометрическое титрование.
2. Аргентометрическое титрование
Метод основан на реакции осаждения ионов С1~ и Вг~ катионами серебра с образованием малорастворимых галогенидов:
Cl-+Ag+=AgClb Br^- + Ag+= AgBr
При этом используют раствор нитрата серебра. Если же анализируют вещество на содержание серебра, то пользуются раствором хлорида натрия (или калия). титрование раствор препарат
Для понимания метода аргентометрии большое значение имеют кривые титрования. В качестве примера рассмотрим случай титрования 10,00 мл 0,1 н. раствора хлорида натрия 0,1 н. раствором нитрита серебра (без учета изменения объема раствора).
До начала титрования концентрации хлорид-ионов в растворе равна общей концентрации хлорида натрия, т. е. 0,1 моль/л или = --lg lO-i = 1.
Когда к титруемому раствору хлорида натрия будет прибавлено 9,00 мл раствора нитрата серебра и 90% хлорид-ионов будут осаждены, концентрация их в растворе уменьшится в 10 раз и станет равна Ы0~ 2 моль/л, а рС1 будет равен 2. Поскольку же величина nPAgci= IQ- 10 , концентрация ионов серебра при этом составит:
10-ю/[С1-] = Ю-Ю/10-2 = 10-8 М оль/л, ИЛИ pAg= -- lg = -- IglO-s = 8.
Аналогичным образом вычисляют все остальные точки для построения кривой титрования. В точке эквивалентности pCl=pAg= = 5 (см. табл.).
Таблица Изменение рС\ и pAg при титровании 10,00 мл 0,1 н. раствора хлорида натрия 0,1 н. раствором нитрата серебра
|
Прибавлено раствора AgNO 3 , |
|||||
|
9,99 10,00 (точка экв.) 10,01 |
ю- 4 ю- 5 ю- 6 . |
ю- 6 ю- 5 ю-* |
|||
Интервал скачка при аргентометрическом титровании зависит от концентрации растворов и от значения произведения растворимости осадка. Чем меньше величина ПР получающегося в результате титрования соединения, тем шире интервал скачка на кривой титрования и тем легче фиксировать конечную точку титрования с помощью индикатора.
Наиболее распространено аргентометрическое определение хлора по методу Мора. Сущность его состоит в прямом титровании жидкости раствором нитрата серебра с индикатором хроматом калия до побурения белого осадка.
Индикатор метода Мора -- раствор К2СгО 4 дает с нитратом серебра красный осадок хромата серебра Ag 2 CrO 4 , но растворимость осадка (0,65-10~ 4 Э/л) гораздо больше растворимости хлорида серебра (1.25Х _Х10~ 5 Э/л). Поэтому при титровании раствором нитрата серебра в присутствии хромата калия красный осадок хромата серебра появляется лишь после добавления избытка ионов Ag+, когда все хлорид-ионы уже осаждены. При этом всегда к анализируемой жидкости приливают раствор нитрата серебра, а не наоборот.
Возможности применения аргентометрии довольно ограничены. Ее используют только при титровании нейтральных или слабощелочных растворов (рН от 7 до 10). В кислой среде осадок хромата серебра растворяется.
В сильнощелочных растворах нитрат серебра разлагается с выделением нерастворимого оксида Ag 2 O. Метод непригоден и для анализа растворов, содержащих ион NH^", так как при этом образуется с катионом Ag + аммиачный комплекс + - Анализируемый раствор не должен содержать Ва 2 +, Sr 2+ , Pb 2+ , Bi 2+ и других ионов, дающих осадки с хроматом калия. Тем не менее аргентометрия удобна при анализе бесцветных растворов, содержащих С1~ и Вг_-ионы.
3. Тиоцианатометрическое титрование
Тиоцианатометрическое титрование основано на осаждении ионов Ag+ (или Hgl +) тиоцианатами:
Ag+ + SCN- = AgSCN|
Для определения необходим раствор NH 4 SCN (или KSCN). Определяют Ag+ или Hgi + прямым титрованием раствором тиоцианата.
Тиоцианатометрическое определение галогенов выполняют по так называемому методу Фольгарда. Суть его можно выразить схемами:
CI- + Ag+ (избыток) -* AgCI + Ag+ (остаток), Ag+ (остаток) + SCN~-> AgSCN
Иначе говоря, к жидкости, содержащей С1~, приливают избыток титрованного раствора нитрата серебра. Затем остаток AgNO 3 обратно оттитровывают раствором тиоцианата и вычисляют результат.
Индикатор метода Фольгарда -- насыщенный раствор NH 4 Fe(SO 4) 2 - 12H 2 O. Пока в титруемой жидкости имеются ионы Ag+, прибавляемые анионы SCN~ связываются с выделением осадка AgSCN, но не взаимодействуют с ионами Fe 3+ . Однако после точки эквивалентности малейший избыток NH 4 SCN (или KSCN) вызывает образование кроваво-красных ионов 2 + и +. Благодаря этому удается определить эквивалентную точку.
Тиоцианатометрические определения применяют чаще, чем аргентометрические. Присутствие кислот не мешает титрованию по методу Фольгарда и даже способствует получению более точных результатов, так как кислая среда подавляет гидролиз соли Fe**. Метод позволяет определять ион С1~ не только в щелочах, но и в кислотах. Определению не мешает присутствие Ва 2 +, РЬ 2 +, Bi 3 + и некоторых других ионов. Однако если в анализируемом растворе имеются окислители или соли ртути, то применение метода Фольгарда становится невозможным: окислители разрушают ион SCN-, а катион ртути осаждает его.
Щелочной исследуемый раствор нейтрализуют перед титрованием азотной кислотой, иначе ионы Fe 3 +, входящие в состав индикатора, дадут осадок гидроксида железа (III).
4. Применение осадительного титрования
4.1 Приготовление стандартизированного раствора нитрата серебра
Первичными стандартами для стандартизации раствора нитрата серебра служат хлориды натрия или калия. Готовят стандартный раствор хлорида натрия и приблизительно 0,02 н. раствор нитрата серебра, стандартизируют второй раствор по первому.
Приготовление стандартного раствора хлорида натрия. Раствор хлорида натрия (или хлорида калия) приготовляют из химически чистой соли. Эквивалентная масса хлорида натрия равна его молярной массе (58,45 г/моль). Теоретически для приготовления 0,1 л 0,02 н. раствора требуется 58,45-0,02-0,1 = 0,1169 г NaCl.
Возьмите на аналитических весах навеску приблизительно 0,12 г хлорида натрия, перенесите ее в мерную колбу вместимостью 100 мл, растворите, доведите объем водой до метки, хорошо перемешайте. Вычислите титр и нормальную концентрацию исходного раствора хлорида натрия.
Приготовление 100 мл приблизительно 0,02 н. раствора нитрата серебра. Нитрат серебра является дефицитным реактивом, и обычно растворы его имеют концентрацию не выше 0,05 н. Для данной работы вполне пригоден 0,02 н. раствор.
При аргентометрическом титровании эквивалентная масса AgN0 3 равна молярной массе, т. е. 169,9 г/моль. Поэтому 0,1 л 0,02 н. раствора должны содержать 169,9-0,02-0,1 = 0,3398 г AgNO 3 . Однако брать точно такую навеску не имеет смысла, так как продажный нитрат серебра всегда содержит примеси. Отвесьте на технохимических весах приблизительно 0,34 -- 0,35 г нитрата серебра; цште навеску в мерную колбу вместимостью 100 мл, раствора в небольшом количестве воды и доведите объем водой хранить раствор в колбе, обернув ее черной бумагой и перелить в склянку темного стекла.. Стандартизация раствора нитрата сера по хлориду натрия.. Тщательно вымытую бюретку промойте раствором нитрата серебра и подготовьте eе к титрованию. Пипетку ополосните раствором хлорида натрия и перенесите 10,00 мл раствора в коническую колбу. Прилейте 2 капли насыщенного раствора хромата калия и осторожно, по каплям, титруйте раствором нитрата серебра при перемешивании. Добейтесь, чтобы переход желтой окраски смеси в красноватую произошел от одной избыточной капли нитрата серебра. Повторив титрование 2 -- 3 раза возьмите среднее из сходящихся отсчетов и вычислите нормальную концентрацию раствора нитрата серебра.
Допустим, что на титрование 10,00 мл 0,02097 н. раствора хлорида натрия пошло в среднем 10,26 мл раствора нитрата серебра. Тогда
A^ AgNOj . 10,26 = 0,02097. 10,00, AT AgNOs = 0, 02097- 10, 00/10, 26 = 0,02043
Если предполагается определять содержание С1~ в образце, то вычисляют, кроме того, титр раствора нитрата серебра по хлору: Т,- = 35, 46-0 ,02043/ 1000 = 0,0007244 г/мл, "l это означает, что 1 мл раствора нитрата серебра соответствует 0,0007244 г оттитрованного хлора.
4.2 Приготовление стандартизированного раствор тиоцианата аммони я
Раствор NH 4 SCN или KSCN с точно известным титром нельзя приготовить растворением навески, так как эти соли очень гигроскопичны. Поэтому готовят раствор с приблизительной нормальной.концентрацией и устанавливают ее по стандартизированному раствору нитрата серебра. Индикатором служит насыщенный раствор NH 4 Fe(SO 4) 2 - 12Н 2 О. Чтобы предупредить гидролиз соли Fe, к самому индикатору и к анализируемому раствору прибавляют перед титрованием 6 н. азотную кислоту.
Приготовление 100 мл приблизительно 0,05 н. раствора тиоцианата аммония. Эквивалентная масса NH4SCN равна его молярной массе, т. е. 76,12 г/моль. Поэтому 0,1 л 0,05 н. раствора должны содержать 76,12.0,05-0,1=0,3806 г NH 4 SCN.
Возьмите на аналитических весах навеску около 0,3--0,4 г, перенесите в колбу вместимостью 100 мл, растворите, доведите объем раствора водой до метки и перемешайте.
Стандартизация раствора тиоцианата аммония по нитрату серебра. Подготовьте бюретку для титрования раствором NH 4 SCN. Ополосните пипетку раствором нитрата серебра и отмерьте 10,00мл его в коническую колбу. Добавьте 1 мл раствора NH 4 Fe(SO 4)2 (индикатор) и 3 мл. 6 н. азотной кислоты. Медленно, при непрерывном взбалтывании, приливайте из бюретки раствор NH 4 SCN. Титрование прекратите после появления коричнево-розовой окраски 2 +, не исчезающей при энергичном встряхивании.
Повторите титрование 2--3 раза, из сходящихся отсчетов возьмите среднее и вычислите нормальную концентрацию NH 4 SCN.
Допустим, что на титрование 10,00 мл 0,02043 н. раствора нитрата серебра пошло в среднем 4,10 мл раствора NH 4 SCN.
4.3 Определение содержания хлора в образце по Фольгарду
Галогены по Фольгарду определяют обратным титрованием остатка нитрата серебра раствором NH 4 SCN. Однако точное титрование возможно здесь лишь при условии, что будут приняты меры, предотвращающие (или замедляющие) реакцию между хлоридом серебра и избытком тиоцианата железа:
3AgCI + Fe (SCN) 3 = SAgSCNJ + FeCl 3
при которой появляющаяся сначала окраска постепенно исчезает. Лучше всего отфильтровать осадок AgCl перед титрованием избытка нитрата серебра раствором NH 4 SCN. Но иногда вместо этого к раствору добавляют какую-нибудь органическую жидкость, не смешивают с водой и как бы изолирующую осадок АрС1 от избытка нитрата.
Метод определения. Возьмем пробирку раствором анализируемого вещества, содержащего хлорид натрия. Навеску вещества растворяют в мерной колбе вместимостью 100 мл и доведете объем раствора водой до метки (концентрация хлорида в растворе должна быть не более 0,05 н.).
Перенесите пипеткой 10,00 мл анализируемого раствора в коническую колбу, добавьте 3 мл 6 н. азотной кислоты и прилейте из бюретки заведомый избыток раствора AgNO 3 , например 18,00 мл. Затем осадок хлорида серебра отфильтруйте. Оттитруйте остаток нитрата серебра раствором NH 4 SCN, как описано в предыдущем параграфе. Повторив определение 2--3 раза, возьмите среднее. Если осадок хлорида серебра отфильтровали, то его следует промыть и присоединить промывные воды к фильтрату.
Допустим, что навеска образца составила 0,2254 г. К 10,00 мл анализируемого раствора добавили 18,00 мл 0,02043 н. раствора.нитрата серебра. На титрование избытка его пошло 5,78 мл *0,04982 н. раствора NH 4 SCN.
Прежде всего вычислим, какой объем 0,02043 н. раствора нитрата серебра соответствует затраченным на титрование 5,78 мл 0,04982 н. раствора NH 4 SCN:
следовательно, на осаждение иона С1~ пошло 18,00 -- 14,09 = 3,91 мл 0,2043 н. раствора нитрата серебра. Отсюда легко найти нормальную концентрацию раствора хлорида натрия.
Поскольку эквивалентная масса хлора равна 35,46 г/моль,* общая масса хлора в навеске составляет:
772=0,007988-35,46-0,1 =0,02832 г.
0,2254 г С1-- 100%
х= 0,02832-100/0,2254 = 12,56%.:
0,02832 > С1 -- х%
По методу Фольгарда определяют также содержание ионов Вг~ и I-. При этом отфильтровывать осадки бромида или иодида серебра не требуется. Но нужно учитывать, что ион Fe 3 + окисляет иодиды до свободного иода. Поэтому индикатор добавляют после осаждения всех ионов I- нитратом серебра.
4.4 Определение содержания трихл о рацетата натрия| в техническом препарате (по хлору )
Технический трихлорацетат натрия (ТХА) -- гербицид для тожения сорняков злаков. Он представляет собой кристаллическое вещество белого или светло-коричневого цвета, хорошо растворимое в воде. По Фольгарду сначала определяют массовую долю хлоридо-органических соединений, а затем после разрушения хлора. По разности находят массовую долю (%) хлора трихлор-ацетата натрия.
Определение массовой доли (%) хлора неорганических соединений. Точную навеску препарата 2--2,5 г поместите в мерную колбу вместимостью 250 мл, растворите, доведите раствор водой до метки, перемешайте. Перенесите пипеткой в коническую колбу 10 мл раствора и прилейте 5--10 мл концентрированной азотной кислоты.
Прибавьте из бюретки 5 или 10 мл 0,05 н. раствора нитрата серебра и избыток его оттитруйте 0,05 н. раствором NH 4 SCN в присутствии NH 4 Fe(SO 4) 2 (индикатор).
Массовую долю (%) хлора (х) неорганических соединений вычислите по формуле
(V -- l/i) 0,001773-250х100
где V -- объем точно 0,05 н. раствора AgNO 3 , взятый для анализа; Vi -- объем точно 0,05 н. раствора NH 4 SCN, пошедший на титрование избытка AgNO 3 ; т -- навеска трихлорацетата натрия; 0,001773 -- масса хлора, отвечающая 1 мл 0,05 н. раствора AgNO . Определение массовой доли (%) общего хлора. В коническую колбу возьмите 10 мл приготовленного ранее раствора, прилейте 10 мл раствора с массовой долей NaOH 30% и 50 мл воды. Соедините колбу с обратным шариковым холодильником и кипятите содержимое ее в течение 2 ч. Дайте жидкости остыть, промойте холодильник водой, собирая промывные воды в ту же колбу. Прибавьте к раствору 20 мл разбавленной (1:1) азотной кислоты и прилейте из бюретки 30 мл 0,05 н. раствора нитрата серебра. Избыток нитрата серебра оттитруйте 0,05 н. раствором NH 4 SCN в присутствии NH 4 Fe(SO 4)2. Массовую долю (%) общего хлора (xi) вычислите по приведенной выше формуле. Массовую долю (%) трихлорацетата натрия в препарате (х^) найдите по формуле
х2 = (х1 -- х) (185,5/106,5),
где 185,5 -- молярная масса трихлорацетата натрия; 106,5 -- масса хлора, содержащегося в молярной массе трихлорацетата натрия.
Размещено на Allbest.ru
...Подобные документы
Сущность и классификация методов кислотно-основного титрования, применение индикаторов. Особенности комплексонометрического титрования. Анализ методов осадительного титрования. Обнаружение конечной точки титрования. Понятие аргенометрии и тицианометрии.
контрольная работа , добавлен 23.02.2011
Последовательность расчета кривой титрования раствора соляной кислоты раствором слабого основания гидроксида аммония. Построение кривой титрования, определение точки эквивалентности и прямой нейтральности. Подбор индикатора и вычисление его ошибки.
контрольная работа , добавлен 03.01.2016
Определение содержания носителей щелочности в растворе карбоната натрия методом прямого кислотно-основного титрования. Математическое выражение закона эквивалентов. Построение интегральной и дифференциальной кривых потенциометрического титрования.
лабораторная работа , добавлен 15.02.2012
Понятие и виды титриметрического анализа. Характеристика комплексонообразующих агентов и индикаторов. Приготовление оттитрованного раствора для проведения комплексонометрического титрования. Методика исследования алюминия, висмута, свинца, магния, цинка.
курсовая работа , добавлен 13.01.2013
Метод потенциометрического титрования. Кислотно-основное титрование. Определение конечной точки титрования. Методика проведения потенциометрического титрования. Потенциометрическое титрование, используемые приборы и обработка результатов анализа.
курсовая работа , добавлен 24.06.2008
Классификация методов окислительно-восстановительного титрования. Факторы, оказывающие влияние на скорость реакции. Специфические и редокс-индикаторы. Сущность перманганатометрии, иодометрии, дихроматометрии. Приготовление раствора дихромата калия.
презентация , добавлен 19.03.2015
Расчет индикаторных погрешностей для выбранных индикаторов, кривой титрования 25 мл 0,05 М раствора CH3COOH 0,05 М раствором KOH. Кислотно-основные индикаторы. Этапы титрования: начальная точка, область до точки и область после точки эквивалентности.
контрольная работа , добавлен 18.12.2013
Особенности методов окислительно-восстановительного титрования. Основные требования к реакциям, константа равновесия. Характеристика видов окислительно-восстановительного титрования, его индикаторы и кривые. Приготовление и стандартизация растворов.
курсовая работа , добавлен 25.12.2014
Понятие титраметрического анализа. Окислительно-восстановительное титрование, его виды и условия проведения реакций. Расчет точек кривой титрования, потенциалов, построение кривой титрования. Подборка индикатора, расчет индикаторных ошибок титрования.
курсовая работа , добавлен 10.06.2012
Классификация методов титраметрического анализа. Сущность метода "нейтрализации". Приготовление рабочих растворов. Расчет точек и построение кривых кислотно-основного и окислительно-восстановительного титрования. Достоинства и недостатки йодометрии.
Введение
Лабораторный практикум выполняется после изучения теоретического курса «Аналитическая химия и ФХМА» и служит для закрепления и углубления полученных знаний.
Задачей количественного анализа является определение количества (содержания) элементов (ионов), радикалов, функциональных групп, соединений или фаз в анализируемом объекте . В этом курсе рассматриваются основные методы титриметрического (объемного) анализа, способы титрования и их практическое применение.
Прежде чем приступить к выполнению лабораторного практикума, студенты проходят инструктаж по технике безопасности. Перед выполнением каждой работы студент должен сдать коллоквиум по разделам, указанным преподавателем, а также по методике проведения анализа. Для этого необходимо:
1) повторить соответствующий раздел курса;
2) подробно ознакомиться с методикой проведения работы;
3) составить уравнения химических реакций, лежащих в основе проводимого химического анализа;
4) изучить особенности проведения анализа с точки зрения техники безопасности.
По результатам работы студенты составляют отчёт, в котором должны быть указаны:
· название работы;
· цель работы;
· теоретические основы метода: сущность метода, основное уравнение, расчеты и построение кривых титрования, выбор индикатора;
· реактивы и оборудование, используемые в ходе проведения работы;
· методика анализа:
Приготовление первичных стандартов;
Приготовление и стандартизация рабочего раствора;
Определение содержания исследуемого вещества в растворе;
· экспериментальные данные;
· статистическая обработка результатов анализа;
· выводы.
ТИТРИМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Титриметрический метод анализа основан на измерении объема реагента точно известной концентрации (титранта), затраченного на химическую реакцию с определяемым веществом.
Процедура определения (титрование) состоит в том, что к точно известному объему раствора определяемого вещества с неизвестной концентрацией из бюретки по каплям добавляют титрант, до наступления точки эквивалентности.
где X – определяемое вещество; R – титрант, P – продукт реакции.
Точка эквивалентности (т.э.) – это теоретическое состояние раствора, наступающее в момент добавления эквивалентного количества титранта R к определяемому веществу X . На практике титрант добавляют к определяемому веществу до достижения конечной точкой титрования (к.т.т.), под которой понимают при визуальной индикации точки эквивалентности момент изменения окраски индикатора, добавленного в раствор. Кроме визуальной индикации точка эквивалентности может быть зарегистрирована инструментальными способами. В этом случае под конечной точкой титрования (к.т.т.) понимают момент резкого изменения физической величины, измеряемой в процессе титрования (сила тока, потенциал, электропроводность и т. д.).
В титриметрическом методе анализа используются следующие типы химических реакций: реакции нейтрализации, реакции окисления-восстановления, реакции осаждения и реакции комплексообразования.
В зависимости от типа применяемой химической реакции различают следующие методы титриметрического анализа:
– кислотно-основное титрование;
– осадительное титрование;
– комплексонометрическое титрование или комплексонометрия;
– окислительно-восстановительное титрование или редоксиметрия.
К реакциям, применяемым в титриметрическом методе анализа, предъявляют следующие требования:
· реакция должна протекать в стехиометрических соотношениях, без побочных реакций;
· реакция должна протекать практически необратимо (≥ 99,9 %), константа равновесия реакции К р >10 6 , образующиеся осадки должны иметь растворимость S < 10 -5 моль/дм 3 , а образующиеся комплексы – К уст > 10 -6 ;
· реакция должна протекать с достаточно большой скоростью;
· реакция должна протекать при комнатной температуре;
· точка эквивалентности должна фиксироваться четко и надежно каким-либо способом.
Способы титрования
В любом методе титриметрического анализа существует несколько способов титрования. Различают прямое титрование, обратное титрование и титрование по замещению .
Прямое титрование – к раствору определяемого вещества добавляют по каплям титрант до достижения точки эквивалентности.
Схема титрования: X + R = P .
Закон эквивалентов для прямого титрования:
C (1/ z) Х V Х = C (1/ z) R V R . (2)
Количество (массу) определяемого вещества, содержащееся в исследуемом растворе, вычисляют, используя закон эквивалентов (для прямого титрования)
m Х = C (1/z)R V R M (1/z) Х ٠10 -3 , (3)
где C (1/ z) R – молярная концентрация эквивалента титранта, моль/дм 3 ;
V R – объем титранта, см 3 ;
M (1/ z ) Х – молярная масса эквивалента определяемого вещества;
C (1/ z) Х – молярная концентрация эквивалента определяемого вещества, моль/дм 3 ;
V Х – объем определяемого вещества, см 3 .
Обратное титрование
– используют два титранта. Сначала
к анализируемому раствору добавляют точный объем первого титранта (R 1
), взятый в избытке. Остаток непрореагировавшего титранта R 1 оттитровывают вторым титрантом (R 2
). Количество титранта R 1
, израсходованного
на взаимодействие с анализируемым веществом (Х
) определяют по разности между добавленным объемом титранта R 1
(V 1
) и объемом титранта R 2
(V 2
) затраченного на титрование остатка титранта R 1
.
Схема титрования: X + R 1 фиксированный избыток = P 1 (R 1 остаток).
R 1 остаток + R 2 = P 2 .
При использовании обратного титрования закон эквивалентов записывается следующим образом:
Массу определяемого вещества в случае обратного титрования вычисляют по формуле
Способ обратного титрования применяется в тех случаях, когда для прямой реакции невозможно подобрать подходящий индикатор или она протекает с кинетическими затруднениями (низкая скорость химической реакции).
Титрование по замещению (косвенное титрование) – применяют в тех случаях, когда прямое или обратное титрование определяемого вещества невозможно или вызывает затруднения либо отсутствует подходящий индикатор.
К определяемому веществу Х добавляют какой-либо реагент А в избытке, при взаимодействии с которым выделяется эквивалентное количество вещества Р . Затем продукт реакции Р оттитровывают подходящим титрантом R .
Схема титрования: X + А избыток = P 1.
P 1 + R = P 2.
Закон эквивалентов для титрования по замещению записывают следующим образом:
Так как число эквивалентов определяемого вещества Х и продукта реакции Р одинаковы, расчет массы определяемого вещества в случае косвенного титрования вычисляют по формуле
m Х = C (1/z) R V R M (1/z) Х ٠10 -3 . (7)
Реактивы
1. Янтарная кислота Н 2 С 4 Н 4 О 4 (х.ч.) – первичный стандарт.
2. Раствор гидроксида натрия NaOH с молярной концентрацией
~2,5 моль/дм 3
3. Н 2 О дистиллированная.
Оборудование студенты описывают самостоятельно.
Ход выполнения работы:
1. Приготовление первичного стандарта янтарной кислоты HOOCCH 2 CH 2 COOH.
Янтарную кислоту готовят объемом 200,00 см 3 с молярной концентрацией эквивалента ![]() моль/дм 3 .
моль/дм 3 .
![]() г/моль.
г/моль.
Уравнение реакции:
Взятие навески (взвешивание):
![]()
Масса навески
Навеску количественно
переносят в мерную колбу (![]() см 3), добавляют 50 – 70 см 3 дистиллированной воды, перемешивают до полного растворения янтарной кислоты, доводят до метки дистиллированной водой
см 3), добавляют 50 – 70 см 3 дистиллированной воды, перемешивают до полного растворения янтарной кислоты, доводят до метки дистиллированной водой
и тщательно перемешивают.
рассчитывают
по формуле

Реактивы
1. Карбонат натрия Na 2 CO 3 (х.ч.) – первичный стандарт.
2. Н 2 О дистиллированная.
3. Хлороводородная кислота НСl концентрации 1:1 (r=1,095 г/см 3).
4. Кислотно-основной индикатор (выбирают по кривой титрования).
5. Смешанный индикатор – метиловый оранжевый и метиленовый синий.
Ход выполнения работы:
1. Приготовление первичного стандарта карбоната натрия (Na 2 CO 3).
Раствор карбоната натрия готовят объёмом 200,00 см 3 с молярной концентрацией эквивалента ![]() моль/дм 3 .
моль/дм 3 .
Расчет массы навески, г: (масса берется с точностью до четвертого знака после запятой).
Уравнения реакции:
1) Na 2 CO 3 + HCl = NaHCO 3 + NaCl
2) NaHCO 3 + HCl = NaCl + H 2 O + CO 2
_____________________________________
Na 2 CO 3 +2HCl = 2NaCl + H 2 O + CO 2
H 2 CO 3 – слабая кислота (K a1 = 10 -6,35 , K a2 = 10 -10,32).
Взятие навески (взвешивание):
Масса часового стекла (стакана)
Масса часового стекла (стакана) с навеской ![]()
Масса навески
Навеску количественно
переносят в мерную колбу (![]() см 3), добавляют 50 – 70 см 3 дистиллированной воды, перемешивают до полного растворения карбоната натрия, доводят до метки дистиллированной водой
см 3), добавляют 50 – 70 см 3 дистиллированной воды, перемешивают до полного растворения карбоната натрия, доводят до метки дистиллированной водой
и тщательно перемешивают.
Фактическую концентрацию первичного стандарта
рассчитывают
по формуле

2. Приготовление и стандартизация титранта (раствора HCl)
Раствор хлороводородной кислоты готовят объемом примерно 500 см 3
с молярной концентрацией эквивалента примерно 0,05÷0,06 моль/дм 3)
Титрант – раствор хлороводородной кислоты приблизительной концентрацией 0,05 моль/дм 3 готовят из хлороводородной кислоты, разбавленной 1:1 (r=1,095 г/см 3).
Стандартизацию раствора HCl проводят по первичному стандарту Na 2 CO 3 прямым титрованием, способом пипетирования.
Индикатор выбирают по кривой титрования карбоната натрия хлороводородной кислотой (рис. 4).

Рис. 4. Кривая титрования 100,00 см 3 раствора Na 2 CO 3 с С = 0,1000 моль/дм 3 раствором HCl с С 1/ z = 0,1000 моль/дм 3
При титровании до второй точки эквивалентности используют индикатор метиловый оранжевый, 0,1%-ный водный раствор (рТ = 4,0). Изменение окраски от желтой до оранжевой (цвет «чайной розы»). Интервал перехода
(рН = 3,1 – 4,4) .
Схема 3. Стандартизация раствора HCl

В коническую колбу для титрования вместимостью 250 см 3 помещают аликвоту 25,00 см 3 стандартного раствора Na 2 CO 3 (пипеткой), добавляют 2 – 3 капли метилового оранжевого, разбавляют водой до 50 – 75 см 3 и титруют раствором хлороводородной кислоты до перехода окраски из желтой в цвет «чайной розы» от одной капли титранта. Титрование проводят в присутствии «свидетеля» (исходный раствор Na 2 CO 3 с индикатором). Результаты титрования заносят в табл. 4. Концентрацию хлороводородной кислоты определяют по закону эквивалентов: .
Таблица 4
Результаты стандартизации раствора соляной кислоты
Задачи
1. Сформулируйте понятие эквивалента в кислотно-основных реакциях . Вычислите величину эквивалентов соды и фосфорной кислоты в следующих реакциях:
Na 2 CO 3 + HCl = NaHCO 3 +NaCl
Na 2 CO 3 + 2HCl = 2NaCl + CO 2 + H 2 O
H 3 PO 4 + NaOH = NaH 2 PO 4 + H 2 O
H 3 PO 4 + 2NaOH = Na 2 HPO 4 + H 2 O
H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O
2. Напишите уравнения реакций между соляной кислотой, серной кислотой, гидроксидом натрия, гидроксидом алюминия, карбонатом натрия, гидрокарбонатом калия и рассчитайте эквивалентную массу этих веществ.
3. Постройте кривую титрования 100,00 см 3 соляной кислоты с молярной концентрацией эквивалента 0,1 моль/дм 3 гидроксидом натрия с молярной концентрацией эквивалента 0,1 моль/дм 3 . Выберите возможные индикаторы
4. Постройте кривую титрования 100,00 см 3 акриловой кислоты (CH 2 =CHCOOH, pK a
= 4,26) с молярной концентрацией эквивалента
0,1 моль/дм 3 гидроксидом натрия с молярной концентрацией эквивалента
0,1 моль/дм 3 . Как изменяется состав раствора в процессе титрования? Выберите возможные индикаторы и рассчитайте индикаторную погрешность титрования.
5. Постройте кривую титрования гидразина (N 2 H 4 +H 2 O, pK b
= 6,03)
с молярной концентрацией эквивалента 0,1 моль/дм 3 соляной кислотой
с молярной концентрацией эквивалента 0,1 моль/дм 3 . В чем сходство
и различие расчетов рН и кривой титрования в сравнении с кривой титрования слабой кислоты щелочью? Выберите возможные индикаторы
и рассчитайте индикаторную погрешность титрования.
6. Вычислите коэффициенты активности и активные концентрации ионов
в 0,001 М растворе сульфата алюминия, 0,05 М карбоната натрия, 0,1 М хлорида калия.
7. Вычислите рН 0,20 М раствора метиламина, если его ионизация в водном растворе описывается уравнением
В + Н 2 О = ВН + + ОН - , К b = 4,6 ×10 - 3 , где В – основание.
8. Вычислить константу диссоциации хлорноватистой кислоты HOCl, если 1,99 × 10 - 2 М раствор имеет рН = 4,5.
9. Вычислите рН раствора, содержащего 6,1 г/моль гликолевой кислоты (СH 2 (OH)COOH, К а = 1,5 × 10 - 4).
10. Вычислите рН раствора, полученного смешением 40 мл 0,015 М раствора хлороводородной кислоты с:
а) 40 мл воды;
б) 20 мл 0,02 М раствора гидроксида натрия;
в) 20 мл 0,02 М раствора гидроксида бария;
г) 40 мл 0,01 М раствора хлорноватистой кислоты, К а =5,0 × 10 - 8 .
11. Вычислите концентрацию ацетат-иона в растворе уксусной кислоты
c массовой долей 0,1 %.
12. Вычислите концентрацию иона аммония в растворе аммиака c массовой долей 0,1 %.
13. Рассчитайте массу навески карбоната натрия, необходимую для приготовления 250,00 мл 0,5000 М раствора .
14. Рассчитайте объем раствора соляной кислоты с молярной концентрацией эквивалента 11 моль/л и объем воды, которые необходимо взять для приготовления 500 мл 0,5 М раствора соляной кислоты.
15. В 300 мл 0,3 %-ного раствора хлороводородной кислоты растворили 0,15 г металлического магния. Вычислите молярную концентрацию ионов водорода, магния и хлора в полученном растворе.
16. При смешении 25,00 мл раствора серной кислоты с раствором хлорида бария получено 0,2917 г сернокислого бария. Определите титр раствора серной кислоты.
17. Вычислить массу карбоната кальция, вступившего в реакцию
с 80,5 ммоль хлороводородной кислоты.
18. Сколько граммов однозамещенного фосфата натрия надо добавить
к 25,0 мл 0,15 М раствора гидроксида натрия, чтобы получить раствор с рН=7? Для фосфорной кислоты pK а1
= 2,15; pK а2
= 7,21; pK а3 =
12,36.
19. На титрование 1,0000 г дымящейся серной кислоты, тщательно разбавленной водой, расходуется 43,70 мл 0,4982 М раствора гидроксида натрия. Известно, что дымящаяся серная кислота содержит серный ангидрид, растворенный в безводной серной кислоте. Вычислить массовую долю серного ангидрида в дымящей серной кислоте.
20. Абсолютная погрешность измерения объема с помощью бюретки составляет 0,05 мл. Рассчитать относительную погрешность измерения объемов в 1; 10 и 20 мл.
21. В мерной колбе вместимостью 500,00 мл приготовлен раствор
из навески 2,5000 г карбоната натрия. Вычислить:
а) молярную концентрацию раствора;
б) молярную концентрацию эквивалента (½ Na 2 CO 3);
в) титр раствора;
г) титр по соляной кислоте.
22. Какой объем 10 %-ного раствора карбоната натрия плотностью
1,105 г/см 3 нужно взять для приготовления:
а) 1 л раствора с титром ТNa 2 CO 3 = 0,005000 г/см 3 ;
б) 1 л раствора с ТNa 2 CO 3 /HCl = 0,003000 г/см 3 ?
23. Какой объем соляной кислоты с массовой долей 38,32 % и плотностью 1,19 г/см 3 следует взять для приготовления 1500 мл 0,2 М раствора?
24. Какой объем воды нужно добавить к 1,2 л 0,25 М HCl, чтобы приготовить 0,2 М раствор?
25. Из 100 г технического гидроксида натрия, содержащего 3 % карбоната натрия и 7 % индифферентных примесей, приготовили 1л раствора. Вычислить молярную концентрацию и титр по соляной кислоте полученного щелочного раствора, считая, что карбонат натрия титруется до угольной кислоты.
26. Имеется образец, в котором может содержаться NaOH, Na 2 CO 3 , NaHCO 3 или смесь названных соединений массой 0,2800 г. Пробу растворили в воде.
На титрование полученного раствора в присутствии фенолфталеина расходуется 5,15 мл, а в присутствии метилового оранжевого – 21,45 мл соляной кислоты с молярной концентрацией эквивалента 0,1520 моль/л. Определить состав образца и массовые доли компонентов в образце.
27. Постройте кривую титрования 100,00 см 3 0,1000 М раствора аммиака 0,1000 М раствором соляной кислоты, обоснуйте выбор индикатора.
28. Вычислите рН точки эквивалентности, начала и конца титрования 100,00 см 3 0,1000 М раствора малоновой кислоты (HOOCCH 2 COOH) 0,1000 М раствором гидроксида натрия (рК а 1 =1,38; рК а 2 =5,68).
29. На титрование 25,00 см 3 раствора карбоната натрия с молярной концентрацией эквивалента 0,05123 моль/дм 3 пошло 32,10 см 3 соляной кислоты. Вычислите молярную концентрацию эквивалента соляной кислоты.
30. Сколько мл 0,1 М раствора хлорида аммония необходимо добавить
к 50,00 мл 0,1 М раствора аммиака, чтобы получился буферный раствор
с рН=9,3.
31. Смесь серной и фосфорной кислот перенесли в мерную колбу объемом 250,00 см 3 . Для титрования взяли две пробы по 20,00 см 3 , одну оттитровали раствором гидроксида натрия с молярной концентрацией эквивалента
0,09940 моль/дм 3 с индикатором метилоранжем, а вторую с фенолфталеином. Расход гидроксида натрия в первом случае составил 20,50 см 3 , а во втором 36,85 см 3 . Определите массы серной и фосфорной кислот в смеси.
В комплексонометрии
До точки эквивалентности =(C M V M – C ЭДТА V ЭДТА)/(V М +V ЭДТА). (21)
В точке эквивалентности = ![]() . (22)
. (22)
После точки эквивалентности =  . (23)
. (23)
На рис. 9 показаны кривые титрования иона кальция в буферных растворах с различными значениями рН. Видно, что титрование Са 2+ возможно только при рН ³ 8.
Реактивы
2. Н 2 О дистиллированная.
3. Стандартный раствор Mg (II) с молярной концентрацией
0,0250 моль/дм 3 .
4. Аммиачный буфер с рН = 9,5.
5. Раствор гидроксида калия КОН с массовой долей 5%.
6. Эриохром черный Т, индикаторная смесь.
7. Калькон, индикаторная смесь.
Теоретические основы метода:
Метод основан на взаимодействии ионов Са 2+ и Мg 2+ с динатриевой солью этилендиаминтетрауксусной кислоты (Na 2 H 2 Y 2 или Na-ЭДТА) с образованием прочных комплексов в молярном отношении M:L=1:1 в определённом интервале рН.
Для фиксирования точки эквивалентности при определении Са 2+ и Мg 2+ используют калькон и эриохром черный Т.
Определение Са 2+ проводят при рН ≈ 12, при этом Mg 2+ находится
в растворе в виде осадка гидроксида магния и не титруется ЭДТА.
Mg 2+ + 2OH - = Mg(OH) 2 ↓
Са 2+ + Y 4- « CaY 2-
При рН ≈ 10 (аммиачный буферный раствор) Мg 2+ и Са 2+ находятся
в растворе в виде ионов и при добавлении ЭДТА титруются совместно.
Ca 2+ + HY 3- « CaY 2- + H +
Mg 2+ + HY 3- « MgY 2- +H +
Для определения объема ЭДТА, затраченного на титрование Mg 2+ ,
из суммарного объёма, пошедшего на титрование смеси при рН ≈ 10, вычитают объём, пошедший на титрование Са 2+ при рН ≈ 12.
Для создания рН ≈ 12 применяют 5% – ный раствор KOH, для создания
рН ≈ 10 используют аммиачный буферный раствор (NH 3 ×H 2 O + NH 4 Cl).
Ход выполнения работы:
1. Стандартизация титранта – раствора ЭДТА (Na 2 H 2 Y)
Раствор ЭДТА готовят приблизительной концентрации 0,025 М
из ≈ 0,05 М раствора, разбавляя его дистиллированной водой в 2 раза. Для стандартизации ЭДТА применяют стандартный раствор MgSO 4
c концентрацией 0,02500 моль/дм 3 .
Схема 5. Стандартизация титранта – раствора ЭДТА
 В коническую колбу для титрования вместимостью 250 см 3 помещают 20,00 cм 3 стандартного раствора MgSO 4 c концентрацией 0,02500 моль/дм 3 , добавляют ~ 70 см 3 дистиллированной воды, ~ 10 см 3 аммиачного буферного раствора с рН ~ 9,5 – 10 и вносят индикатор эриохром чёрный Т около 0,05 г
В коническую колбу для титрования вместимостью 250 см 3 помещают 20,00 cм 3 стандартного раствора MgSO 4 c концентрацией 0,02500 моль/дм 3 , добавляют ~ 70 см 3 дистиллированной воды, ~ 10 см 3 аммиачного буферного раствора с рН ~ 9,5 – 10 и вносят индикатор эриохром чёрный Т около 0,05 г
(на кончике шпателя). При этом раствор окрашивается в винно-красный цвет. Раствор в колбе медленно титрируют раствором ЭДТА до перехода окраски из винно-красной в зелёную. Результаты титрования заносят в табл. 6. Концентрацию ЭДТА определяют по закону эквивалентов: ![]() .
.
Таблица 6
Результаты стандартизации раствора ЭДТА
2. Определение содержания Са 2+
Кривые титрования Са 2+ раствором ЭДТА при рН=10 и рН=12 строят самостоятельно.
Раствор задачи в мерной колбе доводят до метки дистиллированной водой и тщательно перемешивают.
Схема 6. Определение содержания Са 2+ в растворе
 В коническую колбу для титрования вместимостью 250 см 3 помещают аликвоту исследуемого раствора 25,00 см 3 , содержащую кальций и магний, добавляют ~ 60 см 3 воды, ~ 10 см 3 5% – ного раствора КОН. После выпадения аморфного осадка Mg(OH) 2 ↓ в раствор вносят индикатор калькон около 0,05 г (на кончике шпателя) и медленно титруют раствором ЭДТА до перехода окраски из розовой в бледно-голубую. Результаты титрования (V
1) заносят в табл.7.
В коническую колбу для титрования вместимостью 250 см 3 помещают аликвоту исследуемого раствора 25,00 см 3 , содержащую кальций и магний, добавляют ~ 60 см 3 воды, ~ 10 см 3 5% – ного раствора КОН. После выпадения аморфного осадка Mg(OH) 2 ↓ в раствор вносят индикатор калькон около 0,05 г (на кончике шпателя) и медленно титруют раствором ЭДТА до перехода окраски из розовой в бледно-голубую. Результаты титрования (V
1) заносят в табл.7.
Таблица 7
| № опыта | Объем ЭДТА, см 3 | Содержание Са 2+ в растворе, г | |
| 25,00 | |
||
| 25,00 | |||
| 25,00 | |||
| 25,00 | |||
| 25,00 |
3. Определение содержания Mg 2+
Кривую титрования Mg 2+ раствором ЭДТА при рН=10 строят самостоятельно.
Схема 7. Определение содержания Mg 2+ в растворе

В коническую колбу для титрования вместимостью 250 см 3 помещают аликвоту 25,00 см 3 исследуемого раствора, содержащую кальций и магний, добавляют ~ 60 см 3 дистиллированной воды, ~ 10 см 3 аммиачного буферного раствора с рН ~ 9,5–10 и вносят индикатор эриохром чёрный Т около 0,05 г
(на кончике шпателя). При этом раствор окрашивается в винно-красный цвет. Раствор в колбе медленно титрируют раствором ЭДТА до перехода окраски из винно-красной в зелёную. Результаты титрования (V
2) заносят в табл. 8.
Таблица 8
Результаты титрования раствора, содержащего кальций и магний
| № опыта | Объем исследуемого раствора, см 3 | Объем ЭДТА, V ∑ , см 3 | Содержание Mg 2+ в растворе, г |
| 25,00 | |||
| 25,00 | |||
| 25,00 | |||
| 25,00 | |||
| 25,00 |
Реактивы
1. Раствор ЭДТА с молярной концентрацией ~ 0,05 моль/дм 3 .
2. Стандартный раствор Cu(II) с титром 2,00×10 -3 г/дм 3 .
3. Н 2 О дистиллированная.
4. Аммиачный буфер с рН~ 8 – 8,5.
5. Мурексид, индикаторная смесь.
Задачи
1. Вычислите α 4 для ЭДТА при pH=5, если константы ионизации ЭДТА следующие: K 1 =1,0·10 -2 , K 2 =2,1·10 -3 , K 3 =6,9·10 -7 , K 4 =5,5·10 -11 .
2. Постройте кривую титрования 25,00 мл 0,020 М раствора никеля 0,010 М раствором ЭДТА при pH=10, если константа устойчивости
К NiY = 10 18,62 . Вычислите p после добавления 0,00; 10,00; 25,00; 40,00; 50,00 и 55,00 мл титранта.
3. На титрование 50,00 мл раствора, содержащего ионы кальция
и магния, потребовалось 13,70 мл 0,12 М раствора ЭДТА при pH=12 и 29,60 мл при pH=10. Выразите концентрации кальция и магния в растворе в мг/мл.
4. При анализе в 1 л воды найдено 0,2173 г оксида кальция и 0,0927 г оксида магния. Вычислите, какой объём ЭДТА концентрации 0,0500 моль/л был затрачен на титрование.
5. На титрование 25,00 мл стандартного раствора, содержащего 0,3840 г сульфата магния, израсходовано 21,40 мл раствора трилона Б. Вычислите титр этого раствора по карбонату кальция и его молярную концентрацию.
6. На основании констант образования (устойчивости) комплексонатов металлов, приведенных ниже, оцените возможность комплексонометрического титрования ионов металлов при pH = 2; 5; 10; 12.
7. При титровании 0,01 М раствора Ca 2+ 0,01 М раствором ЭДТА при pH=10 константа устойчивости K CaY = 10 10,6 . Вычислите, какой должна быть условная константа устойчивости комплекса металла с индикатором при pH=10, если в конечной точке титрования =.
8. Константа кислотной ионизации индикатора, используемого при комплексонометрическом титровании, равна 4,8·10 -6 . Вычислите содержание кислотной и щелочной форм индикатора при pH = 4,9, если его общая концентрация в растворе составляет 8,0·10 -5 моль/л. Определите возможность использования данного индикатора при титровании раствора
с pH=4,9, если цвет его кислотной формы совпадает с цветом комплекса.
9. Для определения содержания алюминия в образце навеску образца 550 мг растворили и добавили 50,00 мл 0,05100 М раствора комплексона III. Избыток последнего оттитровали 14,40 мл 0,04800 М раствором цинка (II). Рассчитайте массовую долю алюминия в образце.
10. При разрушении комплекса, содержащего висмут и йодид-ионы, последние титруют раствором Ag(I), а висмут – комплексоном III.
Для титрования раствора, содержащего 550 мг образца, требуется 14,50 мл 0,05000 М раствора комплексона III, а на титрование йодид-иона, содержащегося в 440 мг образца, затрачивается 23,25 мл 0,1000 М раствора Ag(I). Рассчитайте координационное число висмута в комплексе, если йодид-ионы являются лигандом.
11.
Образец массой 0,3280 г, содержащий Pb, Zn, Cu, растворили
и перевели в мерную колбу на 500,00 см 3 . Определение вели в три этапа:
а) на титрование первой порции раствора объемом 10,00 см 3 , содержащего Pb, Zn, Cu, затрачено 37,50 см 3 0,0025 М раствора ЭДТА; б) во второй порции объемом 25,00 см 3 замаскировали Cu, а на титрование Pb и Zn израсходовано 27,60 см 3 ЭДТА; в) в третьей порции объемом 100,00 см 3 замаскировали Zn
и Cu, на титрование Pb затрачено 10,80 см 3 ЭДТА. Определите массовую долю Pb, Zn, Cu в образце.
Кривые титрования
В редоксметрии кривые титрования строят в координатах Е = f
(C R
),
они иллюстрируют графическое изменение потенциала системы в процессе титрования. До точки эквивалентности потенциал системы рассчитывается по отношению концентраций окисленной и восстановленной форм определяемого вещества (потому что до точки эквивалентности одна из форм титранта практически отсутствует), после точки эквивалентности – по отношению концентраций окисленной и восстановленной форм титранта (потому что после точки эквивалентности определяемое вещество оттитровано практически полностью).
Потенциал в точке эквивалентности определяется по формуле
 , (26)
, (26)
где – число электронов, участвующих в полуреакциях;
– стандартные электродные потенциалы полуреакций.
На рис. 10 представлена кривая титрования раствора щавелевой кислоты H 2 C 2 O 4 раствором перманганата калия KMnO 4 в кислой среде
( = 1 моль/дм 3).

Рис. 10. Кривая титрования 100,00 см 3 раствора щавелевой
кислоты H 2 C 2 O 4 с С 1/ z = 0,1000 моль/дм 3 раствором перманганата
калия KMnO 4 с С 1/ z = 0,1000 моль/дм 3 при =1 моль/дм 3
Потенциал полуреакции MnO 4 - + 5e + 8H + → Mn 2+ + 4H 2 O зависит от рН среды, так как в полуреакции участвуют ионы водорода.
Перманганатометрия
Титрантом является раствор перманганата калия KMnO 4 , являющийся сильным окислителем. Основное уравнение:
MnO 4 - +8H + + 5e = Mn 2+ + 4H 2 O, ![]() =+1,51 В.
=+1,51 В.
М 1/ z (KMnO 4)= ![]() г/моль.
г/моль.
В слабокислых, нейтральных и слабощелочных средах вследствие меньшего окислительно-восстановительного потенциала перманганат-ион восстанавливается до Mn +4 .
MnO 4 - +2H 2 O + 3e = MnО 2 ¯ + 4OH - , ![]() = +0,60 В.
= +0,60 В.
М 1/ z (KMnO 4)= 158,03/3= 52,68 г/моль.
В щелочной среде раствор перманганата калия восстанавливается
до Mn +6 .
MnO 4 - + 1e = MnO 4 2- , ![]() = +0,558 В.
= +0,558 В.
М 1/ z (KMnO 4)= 158,03 г/моль.
Для исключения побочных реакций титрование перманганатом калия проводят в кислой среде, которую создают серной кислотой. Соляную кислоту для создания среды применять не рекомендуется, так как перманганат калия способен окислять хлорид-ион.
2Cl - – 2e = Cl 2 , = +1,359 В.
Наиболее часто перманганат калия применяют в виде раствора
с молярной концентрацией эквивалента ~ 0,05 – 0,1 моль/дм 3 . Он не является первичным стандартом в силу того, что водные растворы перманганата калия способны окислять воду и органические примеси в ней:
4MnO 4- + 2H 2 O = 4MnО 2 ¯+ 3O 2 + 4OH -
Разложение растворов перманганата калия ускоряется в присутствии диоксида марганца. Поскольку диоксид марганца является продуктом разложения перманганата, этот осадок оказывает автокаталитический эффект на процесс разложения.
Твердый перманганат калия, применяемый для приготовления растворов, загрязнен диоксидом марганца, поэтому приготовить раствор из точной навески нельзя. Для того чтобы получить достаточно устойчивый раствор перманганата калия, его после растворения навески KMnO 4 в воде оставляют в темной бутыли на несколько дней (или кипятят), а затем отделяют MnO 2 ¯ фильтрованием через стеклянный фильтр (применять бумажный фильтр нельзя, так как он реагирует с перманганатом калия, образуя диоксид марганца).
Окраска раствора перманганата калия настолько интенсивна,
что индикатор в этом методе не требуется. Для того чтобы придать заметную розовую окраску 100 см 3 воды, достаточно 0,02 – 0,05 см 3 раствора KMnO 4
с молярной концентрацией эквивалента 0,1 моль/дм 3 (0,02 М). Окраска перманганата калия в конечной точке титрования неустойчивая и постепенно обесцвечивается в результате взаимодействия избытка перманганата
с ионами марганца (II), присутствующими в конечной точке в относительно большом количестве:
2MnO 4 - + 3Mn 2+ + 2H 2 O « 5MnО 2 ¯ + 4H +
Стандартизацию рабочего раствора KMnO 4 проводят по оксалату натрия или щавелевой кислоте (свежеперекристаллизованной и высушенной при 105°С).
Используют растворы первичных стандартов с молярной концентрацией эквивалента С (½ Na 2 C 2 O 4) = 0,1000 или 0,05000 моль/л.
C 2 O 4 2- – 2e ® 2CO 2 , = -0,49 В