สมการไฮโดรเจนของเบนซีน คุณสมบัติทางเคมีของเบนซีนและความคล้ายคลึงกัน คุณสมบัติทางเคมีของเบนซีน
คุณสมบัติทางกายภาพ
เบนซีนและความคล้ายคลึงกันที่ใกล้เคียงที่สุดคือของเหลวไม่มีสีและมีกลิ่นเฉพาะ อะโรมาติกไฮโดรคาร์บอนเบากว่าน้ำและไม่ละลายในน้ำ แต่ละลายได้ง่ายในตัวทำละลายอินทรีย์ - แอลกอฮอล์ อีเทอร์ อะซิโตน
เบนซีนและความคล้ายคลึงกันของมันคือตัวทำละลายที่ดีสำหรับหลายๆ คน อินทรียฺวัตถุ- สนามกีฬาทั้งหมดจะถูกเผาไหม้ด้วยเปลวไฟควันเนื่องจากมีคาร์บอนอยู่ในโมเลกุลสูง
คุณสมบัติทางกายภาพของสนามบางแห่งแสดงไว้ในตาราง
โต๊ะ. คุณสมบัติทางกายภาพของสนามบางแห่ง
|
ชื่อ |
สูตร |
ที°.pl., |
ที°.บี.พี. |
|
เบนซิน |
C6H6 |
5,5 |
80,1 |
|
โทลูอีน (เมทิลเบนซีน) |
ค 6 ชั่วโมง 5 CH 3 |
95,0 |
110,6 |
|
เอทิลเบนซีน |
ค 6 ชม. 5 ค 2 ชม. 5 |
95,0 |
136,2 |
|
ไซลีน (ไดเมทิลเบนซีน) |
ค 6 ชั่วโมง 4 (ช 3) 2 |
||
|
ออร์โธ- |
25,18 |
144,41 |
|
|
เมตา- |
47,87 |
139,10 |
|
|
คู่- |
13,26 |
138,35 |
|
|
โพรพิลเบนซีน |
ค 6 ชั่วโมง 5 (ช 2) 2 ช 3 |
99,0 |
159,20 |
|
คิวมีน (ไอโซโพรพิลเบนซีน) |
ค 6 ชั่วโมง 5 CH(CH 3) 2 |
96,0 |
152,39 |
|
สไตรีน (ไวนิลเบนซีน) |
ค 6 ชั่วโมง 5 CH=CH 2 |
30,6 |
145,2 |
เบนซิน – จุดเดือดต่ำ ( ทีก้อน= 80.1°C) ของเหลวไม่มีสี ไม่ละลายในน้ำ
ความสนใจ! เบนซิน – พิษ, ส่งผลต่อไต, การเปลี่ยนแปลงสูตรเลือด (เมื่อสัมผัสเป็นเวลานาน), อาจทำให้โครงสร้างของโครโมโซมเสียหายได้
อะโรมาติกไฮโดรคาร์บอนส่วนใหญ่เป็นอันตรายถึงชีวิตและเป็นพิษ
การเตรียม arenes (เบนซินและความคล้ายคลึงกัน)
ในห้องปฏิบัติการ
1. การรวมตัวของเกลือ กรดเบนโซอิกด้วยด่างที่เป็นของแข็ง
C6H5-COONa + NaOH เสื้อ →ค 6 H 6 + นา 2 CO 3
โซเดียมเบนโซเอต
2. ปฏิกิริยา Wurtz-Fitting: (ในที่นี้ G คือฮาโลเจน)
ค 6ชม 5 -G + 2นา + ร-ก →ค 6 ชม 5 - ร + 2 นาช
กับ 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
ในอุตสาหกรรม
- แยกได้จากน้ำมันและถ่านหินโดยการกลั่นและการปฏิรูปแบบแยกส่วน
- จากน้ำมันถ่านหินและก๊าซเตาอบโค้ก
1. ดีไฮโดรไซไลเซชันของอัลเคนที่มีคาร์บอนมากกว่า 6 อะตอม:
C6H14 ที , กท→ค 6 ชม. 6 + 4 ชม. 2
2. การตัดทอนอะเซทิลีน(เฉพาะน้ำมันเบนซินเท่านั้น) – ร. เซลินสกี้:
3ซี2 เอช 2 600°ค, กระทำ. ถ่านหิน→ค 6 ชั่วโมง 6
3. การดีไฮโดรจีเนชันไซโคลเฮกเซนและความคล้ายคลึง:
นักวิชาการชาวโซเวียต นิโคไล ดมิตรีเยวิช เซลินสกี ยอมรับว่าเบนซีนเกิดขึ้นจากไซโคลเฮกเซน (การดีไฮโดรจีเนชันของไซโคลอัลเคน
C6H12 ที แคท→ค 6 ชม. 6 + 3 ชม. 2

C6H11-CH3 ที , กท→ค 6 ชม. 5 -CH 3 + 3 ชม. 2
เมทิลไซโคลเฮกแซนโทลูอีน
4. อัลคิเลชันของเบนซีน(การเตรียมความคล้ายคลึงกันของเบนซีน) – r Friedel-หัตถกรรม.
C 6 H 6 + C 2 H 5 -Cl เสื้อ, AlCl3→C 6 H 5 -C 2 H 5 + HCl
คลอโรอีเทน เอทิลเบนซีน

คุณสมบัติทางเคมีของอารีเนส
ฉัน- ปฏิกิริยาออกซิเดชัน
1. การเผาไหม้ (เปลวไฟควัน):
2C6H6 + 15O2 ที→12CO 2 + 6H 2 O + Q
2. ภายใต้สภาวะปกติ เบนซีนจะไม่เปลี่ยนสีน้ำโบรมีนและสารละลายโพแทสเซียมเปอร์แมงกาเนตที่เป็นน้ำ
3. ความคล้ายคลึงกันของเบนซีนถูกออกซิไดซ์โดยโพแทสเซียมเปอร์แมงกาเนต (โพแทสเซียมเปอร์แมงกาเนตเปลี่ยนสี):
A) ในสภาพแวดล้อมที่เป็นกรดถึงกรดเบนโซอิก
เมื่อเบนซีนคล้ายคลึงกันสัมผัสกับโพแทสเซียมเปอร์แมงกาเนตและสารออกซิไดซ์ที่แรงอื่นๆ โซ่ด้านข้างจะถูกออกซิไดซ์ ไม่ว่าสายโซ่ขององค์ประกอบทดแทนจะซับซ้อนแค่ไหน มันก็จะถูกทำลาย ยกเว้นอะตอมเอคาร์บอนซึ่งถูกออกซิไดซ์เป็นหมู่คาร์บอกซิล
ความคล้ายคลึงกันของเบนซีนที่มีสายโซ่ด้านเดียวให้กรดเบนโซอิก:
ความคล้ายคลึงกันที่มีสายโซ่สองข้างให้กรดไดบาซิก:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 +28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
ตัวย่อ :
C6H5-CH3+3O KMnO4→C 6 H 5 COOH + H 2 O
B) ในเกลือที่เป็นกลางและเป็นด่างเล็กน้อยถึงเกลือของกรดเบนโซอิก
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
ครั้งที่สอง- ปฏิกิริยาเพิ่มเติม (แข็งกว่าอัลคีน)
1. ฮาโลเจน
ค 6 H 6 +3Cl 2 ชม. ν → C6H6Cl6 (เฮกซาคลอโรไซโคลเฮกเซน - เฮกซะคลอเรน)
2. การเติมไฮโดรเจน
C6H6 + 3H2 ที , พ.ตหรือนิ→ค 6 ชั่วโมง 12 (ไซโคลเฮกเซน)
3. การเกิดพอลิเมอไรเซชัน
สาม. ปฏิกิริยาทดแทน – กลไกไอออน (เบากว่าอัลเคน)
b) ความคล้ายคลึงกันของเบนซีนเมื่อมีการฉายรังสีหรือการให้ความร้อน
คุณสมบัติทางเคมีของอนุมูลอัลคิลมีความคล้ายคลึงกับอัลเคน อะตอมไฮโดรเจนในพวกมันจะถูกแทนที่ด้วยฮาโลเจนโดยกลไกอนุมูลอิสระ ดังนั้นในกรณีที่ไม่มีตัวเร่งปฏิกิริยา เมื่อได้รับความร้อนหรือการฉายรังสี UV จะเกิดปฏิกิริยาการแทนที่อนุมูลอิสระเกิดขึ้นในสายโซ่ด้านข้าง อิทธิพลของวงแหวนเบนซีนต่อสารทดแทนอัลคิลนำไปสู่ความจริงที่ว่า อะตอมไฮโดรเจนจะถูกแทนที่ด้วยอะตอมของคาร์บอนที่ถูกพันธะโดยตรงกับวงแหวนเบนซีน (อะตอมของคาร์บอน) เสมอ
1) ค 6 H 5 -CH 3 + Cl 2 ชม. ν → C 6 H 5 -CH 2 -Cl + HCl
c) ความคล้ายคลึงกันของเบนซินเมื่อมีตัวเร่งปฏิกิริยา
ค 6 H 5 -CH 3 + Cl 2 AlCl 3 → (ของผสมออร์ตา, คู่ของอนุพันธ์) +HCl
2. ไนเตรต (ด้วยกรดไนตริก)
C 6 H 6 + โฮ-โน 2 เสื้อ, H2SO4→C 6 H 5 -NO 2 + H 2 O
ไนโตรเบนซีน - กลิ่น อัลมอนด์!
C 6 H 5 -CH 3 + 3HO-NO 2 เสื้อ, H2SO4→ กับ H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-ไตรไนโตรโทลูอีน (โทล, ทีเอ็นที)
การใช้เบนซีนและความคล้ายคลึงกัน
เบนซิน C 6 H 6 เป็นตัวทำละลายที่ดี เบนซินเป็นสารเติมแต่งช่วยปรับปรุงคุณภาพของน้ำมันเชื้อเพลิงของเครื่องยนต์ ทำหน้าที่เป็นวัตถุดิบในการผลิตสารอะโรมาติกหลายชนิด สารประกอบอินทรีย์– ไนโตรเบนซีน C 6 H 5 NO 2 (ตัวทำละลายที่ได้รับอะนิลีน), คลอโรเบนซีน C 6 H 5 Cl, ฟีนอล C 6 H 5 OH, สไตรีน ฯลฯ
โทลูอีน C 6 H 5 –CH 3 – ตัวทำละลายที่ใช้ในการผลิตสีย้อม ยา และวัตถุระเบิด (TNT (TNT) หรือ 2,4,6-trinitrotoluene TNT)
ไซลีน C6H4(CH3)2. เทคนิคไซลีนเป็นส่วนผสมของไอโซเมอร์ 3 ชนิด ( ออร์โธ-, เมตาดาต้า- และ คู่-ไซลีน) – ใช้เป็นตัวทำละลายและผลิตภัณฑ์เริ่มต้นสำหรับการสังเคราะห์สารประกอบอินทรีย์หลายชนิด
ไอโซโพรพิลเบนซีน C 6 H 5 –CH(CH 3) 2 ใช้ในการผลิตฟีนอลและอะซิโตน
อนุพันธ์คลอรีนของเบนซีนใช้สำหรับการป้องกันพืช ดังนั้นผลิตภัณฑ์ของการแทนที่อะตอม H ในเบนซีนด้วยอะตอมของคลอรีน - hexachlorobenzene C 6 Cl 6 - เป็นสารฆ่าเชื้อรา ใช้สำหรับโรยข้าวสาลีและเมล็ดข้าวไรย์แบบแห้งเพื่อขจัดคราบเขม่า ผลิตภัณฑ์จากการเติมคลอรีนลงในเบนซีนคือ hexachlorocyclohexane (hexachlorane) C 6 H 6 Cl 6 - ยาฆ่าแมลง; มันถูกใช้เพื่อควบคุมแมลงที่เป็นอันตราย สารที่กล่าวถึงเป็นของยาฆ่าแมลง - วิธีทางเคมีในการต่อสู้กับจุลินทรีย์พืชและสัตว์
สไตรีน C 6 H 5 – CH = CH 2 ทำให้เกิดปฏิกิริยาโพลีเมอร์ได้ง่ายมาก เกิดเป็นโพลีสไตรีน และเมื่อเกิดปฏิกิริยาโคโพลีเมอร์กับบิวทาไดอีน ยางสไตรีน-บิวทาไดอีน
ประสบการณ์วิดีโอ
เบนซีนเป็นสารประกอบไม่อิ่มตัว แต่เราพบว่าโครงสร้างของมันไม่มีพันธะคู่ แต่เป็นพันธะอะโรมาติก - เมฆอิเล็กตรอนแบบแยกส่วน ปฏิกิริยาทั่วไปไฮโดรคาร์บอนไม่อิ่มตัว - การเติมอิเล็กโทรฟิลิกและออกซิเดชัน - ไม่ใช่เรื่องปกติสำหรับเบนซีน ดังนั้นจึงไม่เปลี่ยนสีน้ำโบรมีนและไม่เกิดปฏิกิริยาวากเนอร์ (ออกซิเดชันกับสารละลายโพแทสเซียมเปอร์แมงกาเนตที่อุณหภูมิห้อง) เบนซินนั้นมีลักษณะของปฏิกิริยาที่ไม่นำไปสู่การหยุดชะงักของระบบคอนจูเกตแบบปิด - ปฏิกิริยาการทดแทน หากต้องการทราบว่าการทดแทนประเภทใด (หัวรุนแรง, อิเล็กโทรฟิลิก, นิวคลีโอฟิลิก) เป็นลักษณะของเบนซีน โปรดจำโครงสร้างทางอิเล็กทรอนิกส์ของมัน: โครงกระดูกของโมเลกุลแบนราบและมีเมฆอะโรมาติกอยู่เหนือและใต้ระนาบ เพื่อทำปฏิกิริยากับเมฆอะโรมาติกนี้ รีเอเจนต์ต้องเป็นอิเล็กโทรฟิลิก ดังนั้นเบนซีน (และสารประกอบอะโรมาติกโดยทั่วไป) จึงมีลักษณะเฉพาะคือ ปฏิกิริยาการทดแทนอิเล็กโทรฟิลิก - ตัวอย่างของปฏิกิริยา S E ได้แก่
ในระยะแรก อิเล็กโทรฟิลจะเข้าใกล้โมเลกุลของเบนซีนและทำปฏิกิริยากับเมฆอะโรมาติกทั้งหมด (พวกมันถูกดึงดูดเข้าหากัน) ก่อตัวขึ้น π-ซับซ้อน- เพื่อสร้างรูปแบบใหม่ พันธะโควาเลนต์คาร์บอนอิเล็กโทรฟิลต้องใช้อิเล็กตรอนหนึ่งคู่ อิเล็กโตรฟิลจะดึงมันออกมาจากเมฆอะโรมาติกและก่อตัวขึ้น σ-ซับซ้อน- ไม่ใช่ระบบคอนจูเกตแบบปิดเพราะว่า อะตอมของคาร์บอนที่สร้างพันธะ σ ใหม่จะเข้าสู่การผสมพันธุ์ sp 3 (มันออกจากระนาบและไม่มีวงโคจร p z ที่ไม่ใช่ไฮบริดอีกต่อไป) อะตอมของคาร์บอนที่เหลืออีก 5 อะตอมยังคงมีส่วนร่วมในการผันคำกริยา ก่อตัวเป็นเมฆอิเล็กตรอนร่วมซึ่งมีอิเล็กตรอน 4 ตัวแยกส่วน (6-2=4) ดังนั้น ประจุบวกใน σ-complex มันไม่ได้ถูกกำหนดไว้ที่อะตอมของคาร์บอนจำเพาะ แต่อยู่ตรงกลางของวงแหวนเปิด ดังนั้น σ-คอมเพล็กซ์จึงไม่ใช่โครงสร้างอะโรมาติก เพื่อให้ได้กลิ่นหอมกลับคืนมา จำเป็นต้องแยกไฮโดรเจนโปรตอน (H+) ออก มันถูกดูดซับโดยนิวคลีโอไทล์ (Nu -) ที่เหลืออยู่ในตัวกลางปฏิกิริยา อิเล็กตรอนสองตัว พันธบัตร C-Hกลับไปสู่เมฆอะโรมาติก อะตอมของคาร์บอนก็จะกลายเป็นอีกครั้ง
sp 2 -ไฮบริดและสามารถมีส่วนร่วมในการผันคำกริยา
ขั้นตอนที่จำกัดของปฏิกิริยาการทดแทนอิเล็กโทรฟิลิกคือขั้นตอนของการก่อตัวของ σ-complex เนื่องจาก ในกรณีนี้จะเกิดการสูญเสียความอะโรมาติกซึ่งต้องใช้พลังงาน
ปฏิกิริยาการแทนที่อิเล็กโทรฟิลิกต่างๆ ในเบนซีนดำเนินการตามกลไกทั่วไปและแตกต่างกันเฉพาะในขั้นตอนการก่อตัวของอนุภาคอิเล็กโทรฟิลิกเท่านั้น
ปฏิกิริยาไนเตรชันเบนซินเกิดขึ้นภายใต้การกระทำของส่วนผสมของกรดไนตริกและกรดซัลฟิวริกเข้มข้น (ดูแผนภาพปฏิกิริยาด้านบน) พิจารณากลไกของมัน
 |
ในระยะแรกของปฏิกิริยา กรดไนตริกทำปฏิกิริยากับกำมะถัน ในกรณีนี้ กรดไนตริกทำหน้าที่เป็นเบส โดยรับโปรตอนจากโมเลกุลของกรดซัลฟิวริก (ตามทฤษฎีของเบรินสเตด กรดคือโมเลกุลหรือไอออนที่ให้โปรตอน และฐานคือโมเลกุลหรือไอออนที่รับไฮโดรเจนโปรตอน ). กรดไนตริกที่มีโปรโตเนตเกิดขึ้น ซึ่งเมื่อแยกโมเลกุลของน้ำออก จะกลายเป็นไนตรอนไอออนบวกหรือไนโตรเนียมไอออนบวก นี่คืออนุภาคอิเล็กโทรฟิลิก ดังนั้น, กรดซัลฟูริกทำหน้าที่เป็นตัวเร่งปฏิกิริยาโดยมีส่วนร่วมในการก่อตัวของรีเอเจนต์อิเล็กโทรฟิลิก บทบาทที่สองของกรดซัลฟิวริกคือหน้าที่ของสารกำจัดน้ำ ต้องกำจัดน้ำออกจากทรงกลมปฏิกิริยาเพื่อเปลี่ยนสมดุลไปทางขวา
หลังจากการก่อตัวของอิเล็กโทรฟิล - ไนตรอนไอออนบวก - ปฏิกิริยาจะเกิดขึ้นตามกลไกทั่วไปผ่านการก่อตัวของπ- และ
σ-คอมเพล็กซ์:
โปรดทราบ: ในขั้นตอนของการแปลง σ-คอมเพล็กซ์ไปเป็นไนโตรเบนซีน (ขั้นตอนของคืนอะโรมาติกซิตี้) ไฮโดรเจนโปรตอนจะถูกกำจัดออกโดยการกระทำของไอออนของกรดซัลฟิวริก และกรดซัลฟิวริกจะเกิดขึ้นอีกครั้ง ซึ่งพิสูจน์ได้ว่ามันเป็น ตัวเร่งปฏิกิริยาสำหรับปฏิกิริยานี้
 ตัวเร่ง ปฏิกิริยาฮาโลเจนเป็นสิ่งที่เรียกว่ากรดลิวอิส (ตามทฤษฎีของลูอิส กรดเป็นโมเลกุลหรือไอออนที่เป็นกลางที่สามารถรับอิเล็กตรอนคู่หนึ่งได้): FeCl 3, FeBr 3, AlCl 3, AlBr 3 เป็นต้น จำเป็นต้องใช้ตัวเร่งปฏิกิริยาในการโพลาไรซ์โมเลกุลฮาโลเจน กรดลิวอิสจะแทนที่คลอรีนคู่อิเล็กตรอนเดี่ยวๆ ลงบนตัวมันเอง ก่อตัวเป็นสารเชิงซ้อนซึ่งมีประจุบวกบางส่วนเข้มข้นที่อะตอมของคลอรีนตัวใดตัวหนึ่ง:
ตัวเร่ง ปฏิกิริยาฮาโลเจนเป็นสิ่งที่เรียกว่ากรดลิวอิส (ตามทฤษฎีของลูอิส กรดเป็นโมเลกุลหรือไอออนที่เป็นกลางที่สามารถรับอิเล็กตรอนคู่หนึ่งได้): FeCl 3, FeBr 3, AlCl 3, AlBr 3 เป็นต้น จำเป็นต้องใช้ตัวเร่งปฏิกิริยาในการโพลาไรซ์โมเลกุลฮาโลเจน กรดลิวอิสจะแทนที่คลอรีนคู่อิเล็กตรอนเดี่ยวๆ ลงบนตัวมันเอง ก่อตัวเป็นสารเชิงซ้อนซึ่งมีประจุบวกบางส่วนเข้มข้นที่อะตอมของคลอรีนตัวใดตัวหนึ่ง:
ในขั้นตอนของการก่อตัวของ π-complex โพลาไรเซชันเพิ่มเติมของพันธะ Cl-Cl จะเกิดขึ้น และมันจะแตกตัวแบบเฮเทอโรไลซี และ Cl + จะมีส่วนร่วมในการก่อตัวของ σ-complex ทันที
 ดำเนินการในทำนองเดียวกัน ปฏิกิริยาอัลคิเลชัน(ปฏิกิริยาฟรีเดล-คราฟต์)
ดำเนินการในทำนองเดียวกัน ปฏิกิริยาอัลคิเลชัน(ปฏิกิริยาฟรีเดล-คราฟต์)
 |
พันธะ C-Cl ในเมทิลคลอไรด์ไม่มีขั้วเพียงพอที่จะแตกตัวแบบเฮเทอโรไลต์ ภายใต้การกระทำของกรดลูอิส ประจุบวกบางส่วนบนอะตอมคาร์บอนจะเพิ่มขึ้น และความซับซ้อนของรีเอเจนต์ที่มีตัวเร่งปฏิกิริยาจะเป็นอิเล็กโทรฟิลที่แข็งแกร่งกว่าเมทิลคลอไรด์ดั้งเดิม
ปฏิกิริยาซัลโฟเนชันเบนซินเกิดขึ้นภายใต้อิทธิพลของ oleum (สารละลายของซัลฟิวริกแอนไฮไดรด์ SO 3 ในกรดซัลฟิวริกเข้มข้น)
โมเลกุลซัลฟิวริกแอนไฮไดรด์เป็นอิเล็กโทรไลต์เนื่องจากมีประจุบวกบางส่วนขนาดใหญ่บนอะตอมกำมะถัน
 |
เมื่อสารประกอบเชิงซ้อน π ถูกสร้างขึ้น พันธะ S=O (โดยหลักคือพันธะ π) จะถูกโพลาไรซ์และแตกออกในลักษณะเฮเทอโรไลติก ดังนั้น เมื่อสารประกอบเชิงซ้อน σ เกิดขึ้น ประจุลบทั้งหมดจะปรากฏบนอะตอมออกซิเจน เพื่อคืนสภาพอะโรมาติก ไฮโดรเจนโปรตอนจะถูกแยกออกจากอะตอมคาร์บอนของวงแหวนและไปยังออกซิเจนที่มีประจุลบ กรดเบนซีนซัลโฟนิกเกิดขึ้น
เมื่อเราพิจารณาปฏิกิริยาทดแทนอิเล็กโทรฟิลิกในเบนซีน เราจะไม่เผชิญกับคำถามว่าปฏิกิริยาจะเกิดขึ้นในตำแหน่งใด เพราะ อะตอมของคาร์บอนทั้งหมดมีความเท่าเทียมกันอย่างแน่นอน เป็นอีกเรื่องหนึ่งถ้าวงแหวนเบนซีนมีสารทดแทนอยู่แล้ว ในกรณีนี้ อันเป็นผลมาจากการทดแทนอิเล็กโทรฟิลิก การก่อตัวของไอโซเมอร์ทั้งสามจึงเป็นไปได้โดยพื้นฐาน:
 |
เพื่อตอบคำถามว่าผลิตภัณฑ์ใดที่เป็นไปได้เหล่านี้มีความโดดเด่นจึงจำเป็นต้องพิจารณาผลกระทบทางอิเล็กทรอนิกส์ขององค์ประกอบทดแทน
เรามาสรุปจากปฏิกิริยาการแทนที่อิเล็กโทรฟิลิกในเบนซีนและอนุพันธ์ของมัน แล้วพิจารณาผลกระทบทางอิเล็กทรอนิกส์โดยทั่วไป
อิทธิพลซึ่งกันและกันอะตอมในโมเลกุลอินทรีย์
การเชื่อมต่อ เอฟเฟกต์อิเล็กทรอนิกส์
อะตอมและกลุ่มอะตอมในโมเลกุลของสารประกอบอินทรีย์มีอิทธิพลซึ่งกันและกัน และไม่เพียงแต่อะตอมที่เชื่อมต่อถึงกันโดยตรงเท่านั้น อิทธิพลนี้จะถูกส่งผ่านโมเลกุล การถ่ายโอนอิทธิพลของอะตอมในโมเลกุลเนื่องจากโพลาไรเซชันของพันธะเรียกว่าผลกระทบทางอิเล็กทรอนิกส์ - เอฟเฟกต์อิเล็กทรอนิกส์มีสองประเภท: เอฟเฟกต์แบบอุปนัยและแบบมีโซเมอร์
ผลอุปนัย- นี่คือการถ่ายโอนอิทธิพลขององค์ประกอบทดแทนตามสายโซ่ของพันธะ σ เนื่องจากโพลาไรเซชัน ผลอุปนัยแสดงด้วยสัญลักษณ์ I ลองพิจารณาโดยใช้ 1-chlorobutane เป็นตัวอย่าง:
พันธะ C-Cl มีขั้วเนื่องจากค่าอิเล็กโทรเนกาติวีตี้ของคลอรีนสูงกว่า ประจุบวกบางส่วน (δ+) ปรากฏบนอะตอมของคาร์บอน คู่อิเล็กตรอนของพันธะ σ ถัดไปจะเลื่อนไปทางอะตอมคาร์บอนที่มีอิเล็กตรอนไม่เพียงพอ กล่าวคือ โพลาไรซ์ ด้วยเหตุนี้ ประจุบวกบางส่วน (δ+’) จึงปรากฏบนอะตอมคาร์บอนถัดไปด้วย เป็นต้น ดังนั้นคลอรีน ชักนำโพลาไรเซชันไม่เพียงแต่พันธะ σ "ของตัวเอง" เท่านั้น แต่ยังรวมถึงพันธะที่ตามมาในสายโซ่ด้วย โปรดทราบว่าประจุบวกบางส่วนที่ตามมาแต่ละประจุจะมีขนาดน้อยกว่าประจุก่อนหน้า (δ+>δ+’>δ+''>δ+''’) กล่าวคือ ผลอุปนัยจะถูกส่งผ่านวงจรพร้อมการลดทอน สิ่งนี้สามารถอธิบายได้ด้วยความสามารถในการโพลาไรซ์ต่ำของพันธะ σ เป็นที่ยอมรับกันโดยทั่วไปว่าผลอุปนัยขยายไปถึงพันธะ 3-4 σ ในตัวอย่างที่ให้มา อะตอมของคลอรีนจะเลื่อนความหนาแน่นของอิเล็กตรอนไปตามสายโซ่พันธะ ถึงตัวฉันเอง- ผลกระทบนี้เรียกว่าผลกระทบอุปนัยเชิงลบและแสดงแทน –I Cl
สารทดแทนส่วนใหญ่มีผลเชิงลบจากการอุปนัยเพราะว่า โครงสร้างประกอบด้วยอะตอมที่มีอิเลคโตรเนกาติวิตี้มากกว่าไฮโดรเจน (ผลอุปนัยของไฮโดรเจนถือเป็นศูนย์) ตัวอย่างเช่น: -F, -Cl, -Br, -I, -OH, -NH 2, -NO 2,
-COOH, >C=O
 |  |
||
หากองค์ประกอบทดแทนเปลี่ยนความหนาแน่นของอิเล็กตรอนไปตามสายโซ่ของพันธะ σ ดันมันแสดงผลอุปนัยเชิงบวก (+I) ตัวอย่างเช่น:

ออกซิเจนที่มีประจุลบรวมจะมีผลอุปนัยเชิงบวก
![]()
ในโมเลกุลโพรพีน คาร์บอนของกลุ่มเมทิลจะเป็น sp 3 - ไฮบริด และอะตอมของคาร์บอนที่พันธะคู่จะเป็น sp 2 - ไฮบริด เช่น อิเลคโตรเนกาติตีมากขึ้น ดังนั้นหมู่เมทิลจึงเลื่อนความหนาแน่นของอิเล็กตรอนออกไปจากตัวมันเอง ซึ่งแสดงผลอุปนัยเชิงบวก (+I CH 3)
ดังนั้นผลอุปนัยสามารถปรากฏในโมเลกุลใด ๆ ที่มีอะตอมของอิเล็กโตรเนกาติวีตี้ต่างกัน
เอฟเฟกต์เมโซเมอร์– นี่คือการถ่ายโอนอิทธิพลทางอิเล็กทรอนิกส์ขององค์ประกอบทดแทนในระบบคอนจูเกตผ่านโพลาไรเซชันของพันธะ π เอฟเฟกต์ mesomeric ถูกส่งโดยไม่มีการลดทอนเพราะว่า พันธบัตร π มีขั้วได้ง่าย โปรดทราบ: เฉพาะองค์ประกอบแทนที่ซึ่งตัวเองเป็นส่วนหนึ่งของระบบคอนจูเกตเท่านั้นที่มีผล mesomeric ตัวอย่างเช่น:
เอฟเฟกต์ mesomeric อาจเป็นค่าบวก (+M) หรือค่าลบ (-M)
ในโมเลกุลไวนิลคลอไรด์ คลอรีนคู่อิเล็กตรอนเดี่ยวมีส่วนร่วมในการผัน p,π กล่าวคือ การมีส่วนร่วมของคลอรีนต่อระบบคอนจูเกตนั้นมากกว่าการมีส่วนร่วมของอะตอมคาร์บอนแต่ละตัว ดังนั้นคลอรีนจึงมีผลเชิงบวกต่อ mesomeric
 โมเลกุลอะคริลิกอัลดีไฮด์คือ
โมเลกุลอะคริลิกอัลดีไฮด์คือ
π.π-ระบบคอนจูเกต อะตอมออกซิเจนให้อิเล็กตรอนหนึ่งตัวในการผันคำกริยา - เช่นเดียวกับอะตอมของคาร์บอนแต่ละอะตอม แต่ในขณะเดียวกันอิเล็กโทรเนกาติวีตี้ของออกซิเจนจะสูงกว่าคาร์บอน ดังนั้นออกซิเจนจะเปลี่ยนความหนาแน่นของอิเล็กตรอนของระบบคอนจูเกตเข้าหาตัวมันเอง หมู่อัลดีไฮด์เป็น ทั้งหมดมีเอฟเฟกต์ความทรงจำเชิงลบ
ดังนั้นองค์ประกอบทดแทนที่บริจาคอิเล็กตรอนสองตัวเพื่อการผันคำกริยาจะมีผลเชิงบวกต่อ mesomeric ซึ่งรวมถึง:
ก) องค์ประกอบทดแทนที่มีประจุลบสมบูรณ์ เช่น –O - ;
b) องค์ประกอบทดแทนในโครงสร้างซึ่งมีอะตอมที่มีคู่อิเล็กตรอนที่ไม่ได้แบ่งใช้ใน p z orbitals เช่น: -NH 2, -OH,
-F, -Cl, -Br-, -I, -OR (-OCH 3, -OC 2 H 5)
องค์ประกอบที่เปลี่ยนความหนาแน่นของอิเล็กตรอนเข้าหาตัวเองตามระบบคอนจูเกตจะส่งผลลบต่อความทรงจำ ซึ่งรวมถึงองค์ประกอบย่อยที่มีโครงสร้างประกอบด้วยพันธะคู่ เช่น
 |
องค์ประกอบแทนที่สามารถแสดงผลทั้งแบบอุปนัยและแบบมีโซเมอร์พร้อมกัน ในบางกรณี ทิศทางของเอฟเฟกต์เหล่านี้จะเหมือนกัน (เช่น -I และ –M) แต่ทิศทางของเอฟเฟกต์เหล่านี้จะไปในทิศทางตรงกันข้าม (เช่น -I และ +M) ในกรณีเหล่านี้ เราจะทราบผลกระทบโดยรวมขององค์ประกอบทดแทนต่อส่วนที่เหลือของโมเลกุลได้อย่างไร (หรืออีกนัยหนึ่ง เราจะทราบได้อย่างไรว่าองค์ประกอบทดแทนที่กำหนดเป็นการบริจาคอิเล็กตรอนหรือการถอนอิเล็กตรอน) องค์ประกอบที่เพิ่มความหนาแน่นของอิเล็กตรอนในส่วนที่เหลือของโมเลกุลเรียกว่าการบริจาคอิเล็กตรอน และองค์ประกอบทดแทนที่ลดความหนาแน่นของอิเล็กตรอนในส่วนที่เหลือของโมเลกุลเรียกว่าการถอนอิเล็กตรอน
ในการพิจารณาผลกระทบโดยรวมขององค์ประกอบทดแทน จำเป็นต้องเปรียบเทียบผลกระทบทางอิเล็กทรอนิกส์ในขนาด หากผลเป็นสัญญาณบวก แสดงว่าองค์ประกอบทดแทนคือการบริจาคอิเล็กตรอน หากผลกระทบที่มีเครื่องหมายลบมีอิทธิพลเหนือกว่า องค์ประกอบทดแทนจะถูกดึงอิเล็กตรอนออก ควรสังเกตว่าตามกฎแล้ว เอฟเฟกต์ mesomeric จะเด่นชัดมากกว่าเอฟเฟกต์อุปนัย (เนื่องจากความสามารถที่มากกว่าของพันธะ π ในการโพลาไรซ์) อย่างไรก็ตาม มีข้อยกเว้นสำหรับกฎนี้: ผลทางอุปนัยของฮาโลเจนจะรุนแรงกว่าผลแบบมีโซเมอร์
ลองดูตัวอย่างที่เฉพาะเจาะจง:
ในสารประกอบนี้หมู่อะมิโนเป็นองค์ประกอบทดแทนที่ให้อิเล็กตรอนเพราะว่า เอฟเฟกต์ mesomeric เชิงบวกนั้นแข็งแกร่งกว่าเอฟเฟกต์อุปนัยเชิงลบ
 ในสารประกอบนี้ หมู่อะมิโนคือบริเวณที่ดึงอิเล็กตรอนออกมา เนื่องจาก แสดงผลทางอุปนัยด้านลบเท่านั้น
ในสารประกอบนี้ หมู่อะมิโนคือบริเวณที่ดึงอิเล็กตรอนออกมา เนื่องจาก แสดงผลทางอุปนัยด้านลบเท่านั้น
ในโมเลกุลฟีนอล หมู่ไฮดรอกซิลเป็นองค์ประกอบทดแทนที่ให้อิเล็กตรอน เนื่องจากมีผลเหนือกว่าของผล mesomeric เชิงบวกมากกว่าผลอุปนัยเชิงลบ
 ในโมเลกุลเบนซิลแอลกอฮอล์ หมู่ไฮดรอกซิลไม่มีส่วนร่วมในการผันคำกริยาและแสดงเฉพาะผลเชิงลบเชิงเหนี่ยวนำเท่านั้น ดังนั้นจึงเป็นองค์ประกอบทดแทนที่ดึงอิเล็กตรอนออกมา
ในโมเลกุลเบนซิลแอลกอฮอล์ หมู่ไฮดรอกซิลไม่มีส่วนร่วมในการผันคำกริยาและแสดงเฉพาะผลเชิงลบเชิงเหนี่ยวนำเท่านั้น ดังนั้นจึงเป็นองค์ประกอบทดแทนที่ดึงอิเล็กตรอนออกมา
ตัวอย่างเหล่านี้แสดงให้เห็นว่าเราไม่สามารถพิจารณาอิทธิพลขององค์ประกอบทดแทนใดๆ โดยทั่วไปได้ แต่ต้องพิจารณาอิทธิพลของมันในโมเลกุลที่เฉพาะเจาะจง
 มีเพียงฮาโลเจนเท่านั้นที่เป็นองค์ประกอบทดแทนที่ดึงอิเล็กตรอนออกมาเสมอเพราะว่า ผลอุปนัยเชิงลบนั้นแข็งแกร่งกว่าผลเชิงบวกของเมโซเมอร์ ตัวอย่างเช่น:
มีเพียงฮาโลเจนเท่านั้นที่เป็นองค์ประกอบทดแทนที่ดึงอิเล็กตรอนออกมาเสมอเพราะว่า ผลอุปนัยเชิงลบนั้นแข็งแกร่งกว่าผลเชิงบวกของเมโซเมอร์ ตัวอย่างเช่น:

ทีนี้ลองกลับมาที่ปฏิกิริยาการแทนที่อิเล็กโทรฟิลิกในอนุพันธ์ของเบนซีน ดังนั้นเราจึงพบว่าสารทดแทนที่มีอยู่ในวงแหวนอยู่แล้วส่งผลต่อปฏิกิริยาการแทนที่อิเล็กโทรฟิลิก อิทธิพลนี้แสดงออกมาอย่างไร?
สารทดแทนส่งผลต่ออัตราการเกิดปฏิกิริยา S E และตำแหน่งของสารทดแทนที่สองที่ใส่เข้าไปในวงแหวน- ลองดูอิทธิพลทั้งสองด้านนี้กัน
ผลกระทบต่อความเร็วของปฏิกิริยา- ยิ่งความหนาแน่นของอิเล็กตรอนในวงแหวนสูงเท่าไร ปฏิกิริยาการแทนที่อิเล็กโทรฟิลิกก็จะเกิดได้ง่ายขึ้นเท่านั้น เป็นที่ชัดเจนว่าองค์ประกอบย่อยที่บริจาคอิเล็กตรอนเอื้อต่อปฏิกิริยา S E (เป็นตัวกระตุ้นวงจร) และองค์ประกอบย่อยที่ถอนอิเล็กตรอนขัดขวางพวกมัน (ปิดใช้งานวงจร) ดังนั้นปฏิกิริยาการทดแทนอิเล็กโทรฟิลิกในอนุพันธ์ของเบนซีนที่มีองค์ประกอบที่ดึงอิเล็กตรอนออกจึงดำเนินการภายใต้เงื่อนไขที่เข้มงวดยิ่งขึ้น
 ให้เราเปรียบเทียบกิจกรรมของฟีนอล โทลูอีน เบนซีน คลอโรเบนซีน และไนโตรเบนซีนในปฏิกิริยาไนเตรชัน
ให้เราเปรียบเทียบกิจกรรมของฟีนอล โทลูอีน เบนซีน คลอโรเบนซีน และไนโตรเบนซีนในปฏิกิริยาไนเตรชัน
เนื่องจากฟีนอลและโทลูอีนมีองค์ประกอบย่อยที่ให้อิเล็กตรอน พวกมันจึงออกฤทธิ์ในปฏิกิริยา SE มากกว่าเบนซีน ในทางตรงกันข้าม คลอโรเบนซีนและไนโตรเบนซีนจะมีฤทธิ์ในปฏิกิริยาเหล่านี้น้อยกว่าเบนซีน เนื่องจาก มีองค์ประกอบที่ดึงอิเล็กตรอนออกมา ฟีนอลมีฤทธิ์มากกว่าโทลูอีนเนื่องจากมีผลเชิงบวกต่อ mesomeric ของกลุ่ม OH คลอรีนไม่ได้เป็นสารทดแทนที่ดึงอิเล็กตรอนออกมาได้แรงเท่ากลุ่มไนโตรเพราะว่า หมู่ไนโตรแสดงผลกระทบทั้งอุปนัยเชิงลบและเชิงลบ ดังนั้นในชุดนี้ กิจกรรมในปฏิกิริยาทดแทนอิเล็กโทรฟิลิกลดลงจากฟีนอลไปเป็นไนโตรเบนซีน ได้มีการทดลองแล้วว่าหากอัตราการเกิดปฏิกิริยาของเบนซีนไนเตรตเป็น 1 ซีรีย์นี้จะมีลักษณะดังนี้:
ด้านที่สองของอิทธิพลขององค์ประกอบทดแทนบนวงแหวนอะโรมาติกต่อปฏิกิริยาการแทนที่อิเล็กโทรฟิลิกเป็นสิ่งที่เรียกว่า การวางแนวการกระทำของสารทดแทน- องค์ประกอบทดแทนทั้งหมดสามารถแบ่งออกเป็นสองกลุ่ม: ortho-, para-orientants (องค์ประกอบย่อยของประเภทที่ 1) และ meta-orientants (องค์ประกอบย่อยของประเภทที่ 2)
ถึง เจ้าหน้าที่ประเภทที่ 1รวมถึง: -OH, -O -, -NH 2, หมู่อัลคิล (-CH 3, -C 2 H 5 ฯลฯ) และฮาโลเจน คุณจะเห็นว่าองค์ประกอบแทนที่เหล่านี้ทั้งหมดแสดงผลเชิงบวกและ/หรือเอฟเฟกต์เมโซเมอริกเชิงบวก ทั้งหมดยกเว้นฮาโลเจน จะเพิ่มความหนาแน่นของอิเล็กตรอนในวงแหวน โดยเฉพาะในตำแหน่งออร์โธและพารา ดังนั้นอิเล็กโทรฟิลจึงถูกส่งไปยังตำแหน่งเหล่านี้ ลองดูสิ่งนี้โดยใช้ฟีนอลเป็นตัวอย่าง:
เนื่องจากผล mesomeric เชิงบวกของกลุ่มไฮดรอกซิล ความหนาแน่นของอิเล็กตรอนจึงถูกกระจายไปทั่วทั้งระบบคอนจูเกต และในตำแหน่งออร์โธและพาราก็จะเพิ่มขึ้นเป็นพิเศษ
 เมื่อฟีนอลถูกทำให้เป็นโบรมีน จะเกิดส่วนผสมของออร์โธ- และพารา-โบรโมฟีนอล:
เมื่อฟีนอลถูกทำให้เป็นโบรมีน จะเกิดส่วนผสมของออร์โธ- และพารา-โบรโมฟีนอล:
ถ้าโบรมีนเกิดขึ้นในตัวทำละลายที่มีขั้ว (น้ำโบรมีน) และใช้โบรมีนมากเกินไป ปฏิกิริยาจะเกิดขึ้นในสามขั้นตอนในคราวเดียว:
 |
ทดแทนประเภทที่ 2คือ: -NH 3 +, -COOH, -CHO (กลุ่มอัลดีไฮด์), -NO 2, -SO 3 H. องค์ประกอบทดแทนทั้งหมดนี้ลดความหนาแน่นของอิเล็กตรอนในวงแหวนอะโรมาติก แต่เนื่องจากการกระจายตัวใหม่ในตำแหน่งเมตาดาต้า มันคือ ไม่ลดลงมากนักเหมือนในออร์โธและพารา ลองดูสิ่งนี้โดยใช้กรดเบนโซอิกเป็นตัวอย่าง:
หมู่คาร์บอกซิลแสดงผลกระทบด้านความทรงจำเชิงลบและอุปนัยเชิงลบ เนื่องจากการกระจายตัวใหม่ทั่วทั้งระบบคอนจูเกตในตำแหน่งเมตา ความหนาแน่นของอิเล็กตรอนจึงยังคงสูงกว่าในตำแหน่งออร์โธและพารา ดังนั้น อิเล็กโทรฟิลจะโจมตีตำแหน่งเมตา:
 |
ปฏิกิริยากลุ่มแรกคือปฏิกิริยาทดแทน เราบอกว่าเอรีนไม่มีพันธะหลายพันธะในโครงสร้างของโมเลกุล แต่มีระบบคอนจูเกตที่ประกอบด้วยอิเล็กตรอน 6 ตัว ซึ่งมีความเสถียรมากและให้ความแข็งแรงเพิ่มเติมแก่วงแหวนเบนซีน ดังนั้นใน ปฏิกริยาเคมีประการแรก การแทนที่อะตอมไฮโดรเจนเกิดขึ้นมากกว่าการทำลายวงแหวนเบนซีน
เราเคยพบปฏิกิริยาการแทนที่เมื่อพูดถึงอัลเคนแล้ว แต่สำหรับปฏิกิริยาเหล่านี้แล้ว ปฏิกิริยาเหล่านี้เป็นไปตามกลไกที่รุนแรง ในขณะที่เอรีนมีลักษณะเฉพาะด้วยกลไกไอออนิกของปฏิกิริยาการแทนที่
อันดับแรกฮาโลเจนคุณสมบัติทางเคมี การแทนที่อะตอมไฮโดรเจนด้วยอะตอมฮาโลเจน คลอรีน หรือโบรมีน
ปฏิกิริยาเกิดขึ้นเมื่อถูกความร้อนและมีส่วนร่วมของตัวเร่งปฏิกิริยาเสมอ ในกรณีของคลอรีน อาจเป็นอะลูมิเนียมคลอไรด์ หรือเฟอร์ริกคลอไรด์สามก็ได้ ตัวเร่งปฏิกิริยาโพลาไรซ์โมเลกุลฮาโลเจน ทำให้เกิดความแตกแยกของพันธะเฮเทอโรไลติกและผลิตไอออน
คลอรีนเป็นไอออนที่มีประจุบวกและทำปฏิกิริยากับเบนซีน
หากเกิดปฏิกิริยากับโบรมีน ตัวเร่งปฏิกิริยาคือไอรอนโบรไมด์หรืออะลูมิเนียมโบรไมด์

สิ่งสำคัญคือต้องสังเกตว่าปฏิกิริยานี้เกิดขึ้นกับโมเลกุลโบรมีน ไม่ใช่กับน้ำโบรมีน เบนซินไม่ทำปฏิกิริยากับน้ำโบรมีน
ฮาโลเจนของเบนซีนคล้ายคลึงกันมีลักษณะเป็นของตัวเอง ในโมเลกุลโทลูอีน หมู่เมทิลเอื้อต่อการแทนที่ในวงแหวน ปฏิกิริยาเพิ่มขึ้น และปฏิกิริยาเกิดขึ้นภายใต้สภาวะที่เบากว่า นั่นคือที่อุณหภูมิห้อง

สิ่งสำคัญคือต้องสังเกตว่าการแทนที่จะเกิดขึ้นในตำแหน่งออร์โธและพาราเสมอ ดังนั้นจึงได้ส่วนผสมของไอโซเมอร์
ที่สองคุณสมบัติของไนเตรตของเบนซีน การนำหมู่ไนโตรเข้าไปในวงแหวนเบนซีน

ของเหลวสีเหลืองหนักที่มีกลิ่นอัลมอนด์ขมจะก่อตัวเป็นไนโตรเบนซีน ดังนั้นปฏิกิริยาจึงมีคุณภาพต่อเบนซีน สำหรับไนเตรตจะใช้ส่วนผสมไนเตรตของกรดไนตริกและกรดซัลฟิวริกเข้มข้น ปฏิกิริยาเกิดขึ้นโดยการให้ความร้อน
ฉันขอเตือนคุณว่าสำหรับไนเตรตของอัลเคนในปฏิกิริยา Konovalov นั้นจะใช้กรดไนตริกเจือจางโดยไม่ต้องเติมกรดซัลฟิวริก
ในระหว่างการไนเตรตของโทลูอีนตลอดจนระหว่างฮาโลเจนจะเกิดส่วนผสมของออร์โธ - และพารา - ไอโซเมอร์

ที่สามสมบัติอัลคิเลชันของเบนซีนกับฮาโลอัลเคน

ปฏิกิริยานี้ทำให้เกิดการนำอนุมูลไฮโดรคาร์บอนเข้าไปในวงแหวนเบนซีน และถือได้ว่าเป็นวิธีการผลิตสารคล้ายคลึงกันของเบนซีน อะลูมิเนียมคลอไรด์ใช้เป็นตัวเร่งปฏิกิริยาซึ่งส่งเสริมการสลายตัวของโมเลกุลฮาโลอัลเคนให้เป็นไอออน จำเป็นต้องมีเครื่องทำความร้อนด้วย
ที่สี่สมบัติอัลคิเลชันของเบนซีนกับอัลคีน

ด้วยวิธีนี้ คุณสามารถได้รับ เช่น คิวมีนหรือเอทิลเบนซีน ตัวเร่งปฏิกิริยาอลูมิเนียมคลอไรด์
2. ปฏิกิริยาเติมเบนซีน
ปฏิกิริยากลุ่มที่สองคือปฏิกิริยาการบวก เราบอกว่าปฏิกิริยาเหล่านี้ไม่ปกติ แต่เกิดขึ้นได้ภายใต้สภาวะที่ค่อนข้างเข้มงวด โดยการทำลายเมฆไพอิเล็กตรอนและการก่อตัวของพันธะซิกมาหกตัว
ประการที่ห้าคุณสมบัติในรายการทั่วไป การเติมไฮโดรเจน การเติมไฮโดรเจน

อุณหภูมิ ความดัน ตัวเร่งปฏิกิริยา นิกเกิล หรือแพลทินัม โทลูอีนสามารถทำปฏิกิริยาในลักษณะเดียวกันได้
ที่หกคุณสมบัติคลอรีน โปรดทราบว่าเรากำลังพูดถึงปฏิกิริยากับคลอรีนโดยเฉพาะ เนื่องจากโบรมีนไม่เข้าสู่ปฏิกิริยานี้
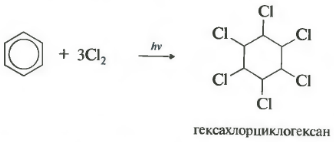
ปฏิกิริยานี้เกิดขึ้นภายใต้การฉายรังสีอัลตราไวโอเลตที่รุนแรง Hexachlorocyclohexane หรือชื่ออื่นของ hexachlorane ซึ่งเป็นของแข็งได้ถูกสร้างขึ้น
สิ่งสำคัญคือต้องจำไว้ว่าสำหรับน้ำมันเบนซิน เป็นไปไม่ได้ปฏิกิริยาการเติมของไฮโดรเจนเฮไลด์ (ไฮโดรฮาโลเจน) และการเติมน้ำ (ไฮเดรชั่น)
3. การทดแทนในห่วงโซ่ด้านข้างของสารเบนซีนที่คล้ายคลึงกัน
ปฏิกิริยากลุ่มที่สามเกี่ยวข้องกับความคล้ายคลึงกันของเบนซีนเท่านั้น - นี่คือการทดแทนในห่วงโซ่ด้านข้าง
ที่เจ็ดคุณสมบัติในรายการฮาโลเจนทั่วไปที่อะตอมคาร์บอนอัลฟ่าในสายโซ่ด้านข้าง

ปฏิกิริยานี้เกิดขึ้นเมื่อถูกความร้อนหรือฉายรังสี และจะเกิดเฉพาะที่อัลฟ่าคาร์บอนเท่านั้น ในขณะที่ฮาโลเจนยังคงดำเนินต่อไป อะตอมฮาโลเจนที่สองจะกลับสู่ตำแหน่งอัลฟา
4. ออกซิเดชันของสารเบนซีนที่คล้ายคลึงกัน
ปฏิกิริยากลุ่มที่สี่คือปฏิกิริยาออกซิเดชัน
วงแหวนเบนซีนแรงเกินไป เบนซีนก็เลย ไม่ออกซิไดซ์โพแทสเซียมเปอร์แมงกาเนตไม่เปลี่ยนสีสารละลาย นี่เป็นสิ่งสำคัญมากที่ต้องจำ
แต่ความคล้ายคลึงกันของเบนซีนจะถูกออกซิไดซ์โดยสารละลายที่เป็นกรดของโพแทสเซียมเปอร์แมงกาเนตเมื่อถูกความร้อน และนี่คือคุณสมบัติทางเคมีประการที่แปด

สิ่งนี้จะผลิตกรดเบนโซอิก สังเกตการเปลี่ยนสีของสารละลาย ในกรณีนี้ ไม่ว่าสายโซ่คาร์บอนขององค์ประกอบแทนที่จะยาวแค่ไหน มันก็จะแตกหลังจากอะตอมของคาร์บอนตัวแรกเสมอ และอะตอมอัลฟ่าจะถูกออกซิไดซ์เป็นหมู่คาร์บอกซิลที่มีการก่อตัวของกรดเบนโซอิก ส่วนที่เหลือของโมเลกุลจะถูกออกซิไดซ์เป็นกรดที่สอดคล้องกัน หรือหากเป็นคาร์บอนเพียงอะตอมเดียวก็จะถูกออกซิไดซ์ คาร์บอนไดออกไซด์.
หากความคล้ายคลึงกันของเบนซีนมีส่วนประกอบของไฮโดรคาร์บอนมากกว่าหนึ่งตัวบนวงแหวนอะโรมาติก การเกิดออกซิเดชันจะเกิดขึ้นตามกฎเดียวกัน - คาร์บอนที่อยู่ในตำแหน่งอัลฟาจะถูกออกซิไดซ์

ใน ในตัวอย่างนี้ได้กรดอะโรมาติก dibasic ซึ่งเรียกว่ากรดทาทาลิก
ฉันอยากจะสังเกตการเกิดออกซิเดชันของคิวมีน ไอโซโพรพิลเบนซีน โดยออกซิเจนในบรรยากาศโดยมีกรดซัลฟิวริกอยู่เป็นพิเศษ

นี่เป็นวิธีที่เรียกว่าคิวมีนในการผลิตฟีนอล ตามกฎแล้ว เราพบปฏิกิริยานี้ในเรื่องที่เกี่ยวข้องกับการผลิตฟีนอล นี่เป็นวิธีการทางอุตสาหกรรม
เก้าคุณสมบัติการเผาไหม้, ออกซิเดชันโดยสมบูรณ์กับออกซิเจน เบนซีนและความคล้ายคลึงกันของมันจะเผาไหม้เป็นคาร์บอนไดออกไซด์และน้ำ
ให้เราเขียนสมการการเผาไหม้ของเบนซีนในรูปแบบทั่วไป
ตามกฎการอนุรักษ์มวล ควรมีอะตอมทางด้านซ้ายเท่ากับจำนวนอะตอมทางด้านขวา เพราะในปฏิกิริยาเคมี อะตอมจะไม่หายไป แต่ลำดับของพันธะระหว่างอะตอมนั้นเปลี่ยนแปลงไป ดังนั้นจะมีโมเลกุลคาร์บอนไดออกไซด์มากเท่ากับอะตอมของคาร์บอนในโมเลกุลอารีน เนื่องจากโมเลกุลประกอบด้วยอะตอมของคาร์บอนหนึ่งอะตอม นั่นคือ n CO 2 โมเลกุล จะมีโมเลกุลของน้ำน้อยกว่าอะตอมไฮโดรเจนถึงสองเท่า นั่นคือ (2n-6)/2 ซึ่งหมายถึง n-3
มีจำนวนอะตอมออกซิเจนทางซ้ายและขวาเท่ากัน ทางด้านขวามี 2n จากคาร์บอนไดออกไซด์ เนื่องจากแต่ละโมเลกุลมีอะตอมออกซิเจน 2 อะตอม บวก n-3 จากน้ำ รวมเป็น 3n-3 ทางด้านซ้ายมีจำนวนอะตอมออกซิเจน 3n-3 เท่ากัน ซึ่งหมายความว่ามีโมเลกุลน้อยกว่าสองเท่า เนื่องจากโมเลกุลประกอบด้วยอะตอม 2 อะตอม นั่นคือ (3n-3)/2 โมเลกุลออกซิเจน
ดังนั้นเราจึงได้รวบรวมสมการสำหรับการเผาไหม้ของสารเบนซีนที่คล้ายคลึงกันในรูปแบบทั่วไป
วงแหวนเบนซีนค่อนข้างเสถียร ปฏิกิริยาทดแทนอะตอมไฮโดรเจนของวงแหวนเบนซีนมีแนวโน้มที่จะเกิดปฏิกิริยาทดแทนมากกว่าปฏิกิริยาเติมที่บริเวณรอยแยกของพันธะคู่ ในสำนวนนี้มันคือ "ลักษณะกลิ่นหอม"
ปฏิกิริยาการทดแทน
ปฏิกิริยาทั่วไปส่วนใหญ่คือการแทนที่ด้วยอิเล็กโทรฟิลิก: ไนเตรชัน, ซัลโฟเนชัน, อัลคิเลชัน (อะซิเลชัน), ฮาโลเจนเนชัน (ฮาโลเจนของเบนซีนที่คล้ายคลึงกันอาจเกิดขึ้นได้จากกลไกที่รุนแรง
1. ไนเตรชัน- การแทนที่ไฮโดรเจนของวงแหวนเบนซีนด้วยกลุ่มไนโตรนั้นดำเนินการด้วยส่วนผสมที่เรียกว่าไนเตรตซึ่งเป็นส่วนผสมของกรดไนตริกและกรดซัลฟิวริกเข้มข้น สารออกฤทธิ์คือไนตรอนไอออนบวก N0 2 +:
HO - N0 2 + 2H 2 S0 4 →N0 2 + + 2HS0 4 - + H 3 0
ไนโตรเนียมไอออนบวก ไฮโดรเนียมไอออนบวก
กลไกของไนเตรต (รวมถึงปฏิกิริยาการทดแทนทั้งหมด) มีดังนี้:
การมีน้ำอยู่ในส่วนผสมของปฏิกิริยาจะรบกวนความก้าวหน้าของปฏิกิริยาเพราะว่า น้ำมีส่วนร่วมในกระบวนการย้อนกลับไปสู่การก่อตัวของไนตรอนไอออนบวก ดังนั้นเพื่อจับกับน้ำที่ปล่อยออกมาในปฏิกิริยาจึงต้องใช้กรดซัลฟิวริกเข้มข้นมากเกินไป
กฎการเปลี่ยนไฮโดรเจนในวงแหวนเบนซีนหากมีองค์ประกอบแทนที่ไฮโดรเจนในวงแหวนเบนซีน ดังนั้นในปฏิกิริยาการแทนที่อิเล็กโทรฟิลิก จะมีบทบาทเป็นตัวกำหนดทิศทาง - ปฏิกิริยาเกิดขึ้นส่วนใหญ่ในตำแหน่งออร์โธและพาราที่สัมพันธ์กับองค์ประกอบแทนที่ (ทิศทางลำดับที่หนึ่ง) หรือตำแหน่งเมตาดาต้า (ปฐมนิเทศประเภทที่สอง).
ทดแทนประเภทแรกสั่งให้อิเล็กโทรไลต์ที่โจมตีไปยังตำแหน่งออร์โธและพาราที่สัมพันธ์กับพวกมัน เรานำเสนอพวกมันตามลำดับแรงปฐมนิเทศจากมากไปน้อย (เอฟเฟกต์อิเล็กโทรดอนเนอร์):
องค์ประกอบย่อยประเภท II สั่งให้อิเล็กโทรไลต์ที่โจมตีไปยังตำแหน่งเมตาดาต้าที่สัมพันธ์กับพวกมัน นอกจากนี้เรายังนำเสนอสิ่งเหล่านี้ตามลำดับแรงปฐมนิเทศจากมากไปน้อย:
ตัวอย่างเช่น -OH - group - orientant ประเภทแรก:


59. เขียนสมการและกลไกของปฏิกิริยาไนเตรตของสารประกอบต่อไปนี้ ก) เบนซิน; b) โทลูอีน; c) คลอโรเบนซีน; ง) ไนโตรเบนซีน; จ) ซัลโฟเบนซีน; f) ฟีนิลไซยาไนด์; ช) เมทอกซีเบนซีน; h) อะมิโนเบนซีน

องค์ประกอบทดแทนประเภทแรกคือการบริจาคอิเล็กตรอน โดยจะเพิ่มความหนาแน่นของเมฆอิเล็กตรอนของวงแหวนเบนซีน โดยเฉพาะอย่างยิ่งในตำแหน่งออร์โธและพารา และด้วยเหตุนี้ (อำนวยความสะดวก) กระตุ้นวงแหวนเบนซีนเพื่อโจมตีอิเล็กโทรฟิล อย่างไรก็ตาม σ-คอมเพล็กซ์ (III) จะไม่เสถียรโดยการเติมแอนไอออน แต่โดยการกำจัดไฮโดรเจนไอออนบวก (พลังงานที่ปล่อยออกมาระหว่างการก่อตัวของเมฆ π-อิเล็กตรอนเดี่ยวของวงแหวนเบนซีนคือ 36.6 กิโลแคลอรี/โมล ):

องค์ประกอบที่สองคือการถอนอิเล็กตรอนออกไป ดูเหมือนว่าพวกมันจะดึงส่วนหนึ่งของเมฆอิเล็กตรอนเข้าหาตัวมันเอง ซึ่งจะช่วยลดความหนาแน่นของเมฆอิเล็กตรอนของวงแหวนเบนซีน โดยเฉพาะอย่างยิ่งในตำแหน่งออร์โธและพาราที่สัมพันธ์กับพวกมัน สารทดแทนประเภทที่สองโดยทั่วไปจะขัดขวางปฏิกิริยาการแทนที่อิเล็กโทรฟิลิก แต่ในตำแหน่งเมตาที่สัมพันธ์กับองค์ประกอบทดแทนประเภทที่สอง ความหนาแน่นของเมฆจะสูงกว่าตำแหน่งอื่นเล็กน้อย ดังนั้นปฏิกิริยาการทดแทนอิเล็กโทรฟิลิกในกรณีขององค์ประกอบทดแทนประเภทที่สองจะไปที่ตำแหน่งเมตา:
 |

กฎเกณฑ์ที่อธิบายไว้ข้างต้นไม่ใช่กฎหมาย เรามักจะพูดถึงเฉพาะทิศทางหลักของปฏิกิริยาเท่านั้น ตัวอย่างเช่น ไนเตรตของโทลูอีนทำให้เกิดออร์โธ-62%, พารา-33.5% และเมตา-ไนโตรโทลูอีน 4.5%
สภาวะของปฏิกิริยา (อุณหภูมิ การมีอยู่ของตัวเร่งปฏิกิริยา ฯลฯ) มีอิทธิพลอย่างมากต่อทิศทางของปฏิกิริยา
เมื่อมีทิศทางสองตัวอยู่ในวงแหวนเบนซีน การวางแนวที่ประสานกันและไม่สอดคล้องกันขององค์ประกอบทดแทนทั้งสองนี้ก็เป็นไปได้ ในกรณีที่การวางแนวที่ไม่สอดคล้องกันขององค์ประกอบทดแทนประเภทเดียวกัน ทิศทางของปฏิกิริยาจะถูกกำหนดโดยองค์ประกอบที่แรงกว่า (ดูแถวขององค์ประกอบทดแทนประเภทที่หนึ่งและสอง):

ในกรณีที่การวางแนวขององค์ประกอบทดแทนไม่สอดคล้องกัน ประเภทต่างๆทิศทางของปฏิกิริยาถูกกำหนดโดยองค์ประกอบทดแทนชนิดที่ 1 เนื่องจากมันจะกระตุ้นวงแหวนเบนซีนให้เป็นการโจมตีด้วยไฟฟ้าเช่น

60. ตามกฎของการทดแทน ให้เขียนไนเตรตของเบนซีนที่ถูกแทนที่ต่อไปนี้: ก) เอ็ม-ไนโตรโทลูอีน; b) p-ไนโตรโทลูอีน; c) โอ-ไฮดรอกซีโทลูอีน; d) p-คลอโรโทลูอีน; จ) กรดเอ็ม-ไนโตรเบนโซอิก; f) p-ออกซีคลอโรเบนซีน; g) m-คลอโรโทลูอีน; h) p-methoxytoluene
2. ปฏิกิริยาซัลโฟเนชันเกิดขึ้นเมื่อ arenes ถูกให้ความร้อนด้วยกรดซัลฟิวริกเข้มข้นหรือโอเลี่ยม สารโจมตีคือโมเลกุล SO 3 ซึ่งมีบทบาทเป็นอิเล็กโทรฟิล:

ระยะแรกของการเกิดซัลโฟเนชันจะช้า โดยทั่วไปปฏิกิริยาสามารถย้อนกลับได้:

กรดซัลโฟนิกมีความแข็งแรงเทียบเท่ากับกรดแร่ ดังนั้นในสารละลายในน้ำจึงมีสถานะแตกตัวเป็นไอออน (III)
61. ให้สมการและกลไกการเกิดปฏิกิริยาซัลโฟเนชันของสารต่อไปนี้ตามกฎการทดแทน:
ก) โทลูอีน; b) โอ-ไซลีน; c) ไนโตรเบนซีน; ง) โอ-ไนโตรโทลูอีน; จ) p-คลอโรไนโตรเบนซีน; ฉ) เอ็ม-ไนโตรโทลูอีน; g) p-อะมิโนโทลูอีน; h) o เมทอกซีโทลูอีน
3. ปฏิกิริยาฮาโลเจนเนชัน arenes ในความเย็นต่อหน้าตัวเร่งปฏิกิริยาเช่น AlCl 3, AlBr 3, FeCl 3 - ปฏิกิริยาอิเล็กโทรฟิลิกทั่วไปเนื่องจากตัวเร่งปฏิกิริยามีส่วนทำให้เกิดโพลาไรเซชันของพันธะในโมเลกุลฮาโลเจน (ขึ้นอยู่กับการแตกร้าว): 
เฟอร์ริกคลอไรด์ปราศจากน้ำทำงานในลักษณะเดียวกัน:

ภายใต้สภาวะของปฏิกิริยาที่รุนแรง (แสง ความร้อน) ฮาโลเจน (คลอรีน โบรมีน) จะแทนที่ไฮโดรเจนของโซ่ด้านข้าง (คล้ายกับฮาโลเจนของอัลเคน):

ภายใต้สภาวะที่รุนแรงยิ่งขึ้น จะเกิดการเติมฮาโลเจนอย่างรุนแรงลงในวงแหวนอะโรมาติก
62 - เขียนสมการและกลไกปฏิกิริยาแล้วตั้งชื่อผลคูณ:
ก) โทลูอีน + คลอรีน (ในที่มีแสงจ้าและให้ความร้อน)
b) โทลูอีน + คลอรีน (ในที่เย็นเมื่อมีตัวเร่งปฏิกิริยา)
c) ไนโตรเบนซีน + คลอรีน (ในที่เย็นเมื่อมีตัวเร่งปฏิกิริยา)
d) p-nitrotoluene + คลอรีน (ในที่มีแสงจ้าและให้ความร้อน)
e) p-nitrotoluene + คลอรีน (ในที่เย็นเมื่อมีตัวเร่งปฏิกิริยา):
f) เอทิลเบนซีน + คลอรีน (ในที่มีแสงสว่างและให้ความร้อน)
g) เอทิลเบนซีน + คลอรีน (ในที่เย็นเมื่อมีตัวเร่งปฏิกิริยา)
h) p-hydroxytoluene + คลอรีน (ในที่เย็นเมื่อมีตัวเร่งปฏิกิริยา)
i) m-nitrotoluene + คลอรีน (ในที่เย็นเมื่อมีตัวเร่งปฏิกิริยา)
j) m-xylene + คลอรีน (ในที่เย็นโดยมีตัวเร่งปฏิกิริยา)
4. อัลคิเลชันของเอรีนในที่ที่มี AlCl 3 (AlBr3) ที่ไม่มีน้ำ haloalkanes alkylate benzene จะง่ายกว่าที่คล้ายคลึงกันรวมถึงอนุพันธ์ของฮาโลเจน (ปฏิกิริยา Gustavson-Friedel-Crafts) ตัวเร่งปฏิกิริยาซึ่งก่อตัวเป็นสารเชิงซ้อน A1Cl 3 จะโพลาไรซ์พันธะ C-Gal จนกระทั่งเกิดการแตกหัก และด้วยเหตุนี้สารอิเล็กโทรฟิลที่โจมตี:

อัลคิเลชันกับอัลคีนต่อหน้า A1Cl 3, BF 3 หรือ H 3 PO 4 นำไปสู่ผลลัพธ์ที่คล้ายกัน (กลไกนี้เป็นอิเล็กโทรฟิลิกด้วย):


อัลคิเลชันกับฮาโลอัลเคนและอัลคีนในขณะที่ปฏิกิริยาอิเล็กโทรฟิลิกดำเนินไปตามกฎสำหรับการแทนที่ไฮโดรเจนบนวงแหวนเบนซีน อย่างไรก็ตาม กระบวนการนี้มีความซับซ้อนเนื่องจากการเกิดอัลคิเลชันเพิ่มเติมของผลิตภัณฑ์ปฏิกิริยาและปรากฏการณ์ที่ไม่พึงประสงค์อื่นๆ เพื่อลดอุณหภูมิหลังให้เหลือน้อยที่สุด ปฏิกิริยาจะดำเนินการที่อุณหภูมิต่ำที่สุดที่เป็นไปได้ ปริมาณตัวเร่งปฏิกิริยาที่เหมาะสมที่สุด และเอรีนส่วนเกินจำนวนมาก
63. ให้สมการและกลไกการเกิดปฏิกิริยาภายใต้เงื่อนไขของ Gustavson-Friedel-Crafts ระหว่างสารต่อไปนี้
ก) เบนซิน + 2-คลอโรโพรเพน b) เบนซิน + 2-คลอโร-2-เมกิลโพรเพน c) เบนซิน + เบนซิลคลอไรด์; d) โบรโมเบนซีน + โบรโมอีเทน; e) โทลูอีน + บิวทิลคลอไรด์; f) โทลูอีน + โบรโมอีเทน; i) p-โบรโมโตลูอีน + ไอโซโพรพิลโบรไมด์; h) m-โบรโมโตลูอีน + โบรโมอีเทน; i) p-โบรโมโตลูอีน + ไอโซโพรพิลโบรไมด์; j) คลอโรเบนซีน + เบนซิลคลอไรด์
64. เขียนสมการปฏิกิริยาสำหรับอัลคิเลชันของเอรีนกับอัลคีนต่อหน้ากรดฟอสฟอริก ให้กลไก:
ก) เบนซิน + เอทิลีน; b) เบนซิน + โพรพิลีน; c) โทลูอีน + เอทิลีน; d) โทลูอีน + โพรพิลีน e) เบนซิน + ไอโซบิวทิลีน; f) โทลูอีน + ไอโซบิวทิลีน; g) m-xylene + เอทิลีน; h) p-xylene + เอทิลีน
5. ปฏิกิริยาออกซิเดชั่น (การกำหนดจำนวนโซ่ด้านข้าง)แกนอะโรมาติกมีความทนทานต่อสารออกซิไดซ์ได้ดีมาก ดังนั้นเบนซินและความคล้ายคลึงกันจึงไม่ทำปฏิกิริยากับโพแทสเซียมเปอร์แมงกาเนตเหมือนอัลเคน นอกจากนี้ยังแสดงถึง "คุณลักษณะที่มีกลิ่นหอม" อีกด้วย แต่เมื่อให้ความร้อนกับสารออกซิไดซ์ที่คล้ายคลึงกันภายใต้สภาวะที่ไม่เอื้ออำนวย วงแหวนของเบนซีนจะไม่ถูกออกซิไดซ์ และโซ่ไฮโดรคาร์บอนด้านข้างทั้งหมด ไม่ว่าจะมีความยาวเท่าใดก็ตาม จะถูกออกซิไดซ์ไปยังหมู่คาร์บอกซิล ผลิตภัณฑ์ออกซิเดชันคือกรดอะโรมาติก จำนวนโซ่ด้านข้างในโฮโมล็อกของเบนซีนดั้งเดิม 1 ถูกกำหนดโดยจำนวนหมู่คาร์บอกซิลในกลุ่มหลัง

65 - เขียนสมการปฏิกิริยาออกซิเดชันของสารต่อไปนี้ ก) เอทิลเบนซีน b) o-ไดเมทิลเบนซีน; c) โพรพิลเบนซีน; d) ไตรเมทิลเบนซีนสามัญ e) p-เมทิลไอโซโพรพิลเบนซีน; ฉ) โอ-ไนโตรโทลูอีน; g) 3-ไนโตร-1-เมทิล-4-เอทิลเบนซีน; h) ไตรเมทิลเบนซีนแบบสมมาตร
6. ปฏิกิริยาการเติมแม้ว่าวงแหวนอะโรมาติกจะมีโอกาสเกิดปฏิกิริยาเติมน้อยกว่าปฏิกิริยาทดแทน แต่ก็เกิดขึ้นได้ภายใต้เงื่อนไขบางประการ คุณลักษณะของปฏิกิริยาการเติมคือฮาโลเจน ไฮโดรเจน โอโซนสามโมลจะถูกเติมลงในเบนซีนหนึ่งโมลเสมอ (หรือคล้ายคลึงกัน) ซึ่งอธิบายได้จากการมีอยู่ของเมฆ π-อิเล็กตรอน เดี่ยวในนิวเคลียสอะโรมาติกด้วยอะตอมเดี่ยวจำนวนหนึ่ง , พลังงานรวมของพันธะคู่ 3 พันธะ (หรือมากกว่า 6 π อิเล็กตรอน)
ก) การเติมไฮโดรเจนเกิดขึ้นเมื่อมีตัวเร่งปฏิกิริยา (Pt, Pd ฯลฯ) ที่อุณหภูมิ 110°C (N.D. Zelinsky และอื่นๆ)

ข)ฮาโลเจนเนชั่นเกิดขึ้นเมื่อไอโบรมีนหรือคลอรีนถูกส่งผ่านเบนซีนเดือดภายใต้อิทธิพลโดยตรง แสงแดดหรือเมื่อได้รับแสงยูวี (หลอดควอตซ์):

วี)โอโซน เช่นเดียวกับอัลคีน อะโรมาติกไฮโดรคาร์บอนสามารถถูกโอโซโนไลซิสได้ง่าย

66. เขียนสมการสำหรับปฏิกิริยาการเติม (ไฮโดรจิเนชัน, ฮาโลเจนภายใต้การฉายรังสี UV, โอโซน) ด้วยอารีต่อไปนี้: ก) โทลูอีน; b) โอ-ไซลีน; c) m-ไซลีน; d) p-ไซลีน; จ) เอทิลเบนซีน; f) โอ-เอทิลโทลูอีน; g) m-เอทิลโทลูอีน; h) p-ไอโซโพรพิลโทลูอีน ตั้งชื่อผลิตภัณฑ์ที่ได้รับ
คำนิยาม
เบนซิน- เป็นของเหลวไม่มีสีมีกลิ่นเฉพาะตัว จุดเดือด 80.1 o C จุดหลอมเหลว 5.5 o C ไม่ละลายในน้ำ เป็นพิษ
คุณสมบัติอะโรมาติกของเบนซีนซึ่งพิจารณาจากลักษณะเฉพาะของโครงสร้างของมันนั้นแสดงออกมาในความเสถียรสัมพัทธ์ของวงแหวนเบนซีนแม้จะมีองค์ประกอบที่ไม่อิ่มตัวของเบนซีนก็ตาม ดังนั้น เบนซีนจึงแตกต่างจากสารประกอบไม่อิ่มตัวที่มีพันธะคู่เอทิลีนตรงที่ทนทานต่อสารออกซิไดซ์
ข้าว. 1. โครงสร้างของโมเลกุลเบนซีนตามเกกุล
การได้รับน้ำมันเบนซิน
วิธีการหลักในการรับเบนซีน ได้แก่ :
— ดีไฮโดรไซไลเซชันของเฮกเซน (ตัวเร่งปฏิกิริยา - Pt, Cr 3 O 2)
CH 3 -(CH 2) 4 -CH 3 → C 6 H 6 + 4H 2 (t o C, p, kat = Cr 2 O 3);
— การดีไฮโดรจีเนชันของไซโคลเฮกเซน
C 6 H 12 → C 6 H 6 + 3H 2 (t หรือ C, kat = Pt, Ni);
— ไตรเมอไรเซชันของอะเซทิลีน (ปฏิกิริยาเกิดขึ้นเมื่อถูกความร้อนถึง 600 o C ตัวเร่งปฏิกิริยาคือถ่านกัมมันต์)
3HC≡CH → C 6 H 6 (t = 600 o C, kat = C แอคทีฟ)
คุณสมบัติทางเคมีของเบนซีน
เบนซีนมีลักษณะเป็นปฏิกิริยาทดแทนที่เกิดขึ้นผ่านกลไกอิเล็กโทรฟิลิก:
ฮาโลเจน (เบนซินทำปฏิกิริยากับคลอรีนและโบรมีนต่อหน้าตัวเร่งปฏิกิริยา - AlCl 3, FeCl 3, AlBr 3)
C 6 H 6 + Cl 2 = C 6 H 5 -Cl + HCl;
- ไนเตรต (เบนซีนทำปฏิกิริยาได้ง่ายกับส่วนผสมไนเตรต - ส่วนผสมของกรดไนตริกและกรดซัลฟูริกเข้มข้น)

- อัลคิเลชันกับอัลคีน
ค 6 H 6 + CH 2 = CH-CH 3 → C 6 H 5 -CH (CH 3) 2
ปฏิกิริยาการเติมเบนซีนนำไปสู่การทำลายระบบอะโรมาติกและเกิดขึ้นภายใต้สภาวะที่ไม่เอื้ออำนวยเท่านั้น:
- ไฮโดรจิเนชัน (ผลิตภัณฑ์ปฏิกิริยา - ไซโคลเฮกเซน)
C 6 H 6 + 3H 2 → C 6 H 12 (t หรือ C, kat = Pt);
- การเติมคลอรีน (เกิดขึ้นภายใต้อิทธิพลของรังสียูวีด้วยการก่อตัวของผลิตภัณฑ์ที่เป็นของแข็ง - hexachlorocyclohexane (hexachlorane) - C 6 H 6 Cl 6)
ค 6 H 6 + 6Cl 2 → C 6 H 6 Cl 6 .
การใช้น้ำมันเบนซิน
เบนซินมีการใช้กันอย่างแพร่หลายในอุตสาหกรรม เคมีอินทรีย์- สารประกอบเกือบทั้งหมดที่มีวงแหวนเบนซีนได้มาจากเบนซีน เช่น สไตรีน ฟีนอล อะนิลีน อารีนที่มีฮาโลเจน เบนซีนใช้สำหรับการสังเคราะห์สีย้อม สารลดแรงตึงผิว และยา
ตัวอย่างการแก้ปัญหา
ตัวอย่างที่ 1
| ออกกำลังกาย | ความหนาแน่นไอของสารคือ 3.482 กรัม/ลิตร ไพโรไลซิสทำให้เกิดเขม่า 6 กรัม และไฮโดรเจน 5.6 ลิตร กำหนดสูตรของสารนี้ |
| สารละลาย | เขม่าคือคาร์บอน ลองหาปริมาณของสารเขม่าตามเงื่อนไขของปัญหา ( มวลฟันกรามคาร์บอนคือ 12 กรัม/โมล): n(C) = ม(C) / ม(C); n(C) = 6/12 = 0.5 โมล ลองคำนวณปริมาณของสารไฮโดรเจน: n(H 2) = V(H 2) / V ม.; n(H2) = 5.6 / 22.4 = 0.25 โมล ซึ่งหมายความว่าปริมาณของสารในอะตอมไฮโดรเจนหนึ่งอะตอมจะเท่ากับ: n(H) = 2 × 0.25 = 0.5 โมล ให้เราแสดงจำนวนอะตอมของคาร์บอนในโมเลกุลไฮโดรคาร์บอนเป็น "x" และจำนวนอะตอมไฮโดรเจนเป็น "y" ดังนั้นอัตราส่วนของอะตอมเหล่านี้ในโมเลกุลคือ: x: y = 0.5: 0.5 = 1:1 จากนั้นสูตรไฮโดรคาร์บอนที่ง่ายที่สุดจะแสดงโดยองค์ประกอบ CH น้ำหนักโมเลกุลของโมเลกุลขององค์ประกอบ CH เท่ากับ: M(CH) = 13 กรัม/โมล มาหาน้ำหนักโมเลกุลของไฮโดรคาร์บอนตามเงื่อนไขของปัญหากัน: M (ค x สูง y) = ρ×V ม.; M (C x H y) = 3.482 x 22.4 = 78 กรัม/โมล มาดูสูตรที่แท้จริงของไฮโดรคาร์บอนกัน: k= ม(ค x สูง y)/ ม(CH)= 78/13 =6, ดังนั้นจึงต้องคูณสัมประสิทธิ์ "x" และ "y" ด้วย 6 จากนั้นสูตรไฮโดรคาร์บอนจะอยู่ในรูปแบบ C 6 H 6 นี่คือน้ำมันเบนซิน |
| คำตอบ | ไฮโดรคาร์บอนที่ต้องการมีองค์ประกอบ C 6 H 6 . นี่คือน้ำมันเบนซิน |
ตัวอย่างที่ 2
| ออกกำลังกาย | คำนวณปริมาณสารอะเซทิลีนที่จำเป็นเพื่อให้ได้เบนซีน 400 มล. (ความหนาแน่น 0.8 กรัม/มิลลิลิตร) |
| สารละลาย | ให้เราเขียนสมการปฏิกิริยาสำหรับการผลิตเบนซีนจากอะเซทิลีน: สิ่งพิมพ์ที่เกี่ยวข้อง
|




